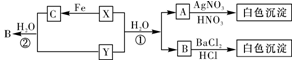
题目内容
17.工业上常用加入K2Cr2O7氧化剂的办法氧化Na2SO3,现已知1mol K2Cr2O7能把3mol Na2SO3恰好氧化为Na2SO4,K2Cr2O7被还原为Crn+,则n的值为( )| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
分析 Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2Cr2O7中Cr元素发生还原反应,令Cr元素在产物中的化合价为a价,根据电子转移守恒计算n的值.
解答 解:令Cr元素在产物中的化合价为+n价,根据电子转移守恒,则:
3mol×(6-4)=1mol×2×(6-n)
解得n=+3
故选B.
点评 本题考查氧化还原反应计算、氧化还原反应概念等,难度不大,表示出得失数目是解题关键,熟练掌握电子转移守恒思想的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.类推法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与 否.根据你所掌握的知识,判断下列类推结论中正确的是( )
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<Iz2 | 氢化物沸点:FH<HCI<HBr<HI |
| B | 用电解熔融MgCI2可制得金属 | 用电解熔融NaCI也可以制取金属钠 |
| C | 将CO:通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | AI与S加热时直接化合生成AI2S3 | Fe与S加热时也能直接化合生Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
8.${\;}_{52}^{235}$U是重要的核工业原料,在自然界的丰度很低.${\;}_{52}^{235}$U的浓缩一直为国际社会所关注.${\;}_{52}^{235}$U左上角的“235”表示( )
| A. | 质量数 | B. | 中子数 | C. | 质子数 | D. | 电子数 |
2.可用如图装置制取(必要时可加热)、净化、收集的气体是( )
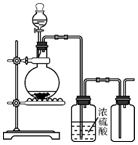

| A. | 铜和稀硝酸制一氧化氮 | B. | 亚硫酸钠与硫酸制二氧化硫 | ||
| C. | 锌和稀硫酸制氢气 | D. | 硫化亚铁与稀硫酸制硫化氢 |
9.关于非金属元素Si、N、S、Cl的叙述,正确的是( )
| A. | 通常情况下,它们的单质均为气体 | B. | 它们在自然界这都存在游离态形式 | ||
| C. | 每种元素都只有一种氧化物 | D. | 它们都存在对应的含氧酸 |
6.下列气态氢化物这最稳定的是( )
| A. | NH3 | B. | H2S | C. | PH3 | D. | H2O |
12.下列有关1mol O2的说法中,不正确的是(NA表示阿伏加德罗常数)( )
| A. | 质量为32g | B. | 含氧原子数为NA | ||
| C. | 含氧分子数为NA | D. | 在标准状况下,体积约为22.4L |