题目内容
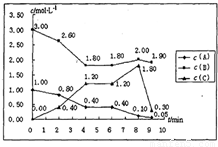
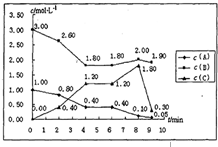 在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:
在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:请仔细分析根据表中数据,回答下列问题:
(1)m=
1
1
,n=2
2
,p=2
2
;(2)计算C的平均反应速率
第0min到第2min:v(C)=
0.2mol/(L?min)
0.2mol/(L?min)
;第2min到第4min:v(C)=
0.4mol/(L?min)
0.4mol/(L?min)
;(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min
使用催化剂
使用催化剂
或升高温度
升高温度
;②第6min增加B的浓度
增加B的浓度
;③第8min减小C的浓度
减小C的浓度
;(4)计算该反应处于平衡状态的温度下的平衡常数
| 10 |
| 9 |
| 10 |
| 9 |
(5)若从开始到第4min建立平衡时反应放出的热量为235.92kJ,则该反应的△H=
-393.2kJ/mol
-393.2kJ/mol
.分析:(1)根据物质的量浓度变化量之比等于化学计量数之比计算m、n、p的值;
(2)根据v=
计算v(C);
(3)影响化学反应速率的因素有:使用催化剂、改变温度、浓度、改变物质的表面积等;
(4)平衡常数为各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以k=
,代入平衡时浓度计算;
(5)在开始到第4min建立平衡时,A物质的消耗量为0.6mol/L×1L=0.6mol,根据化学方程式计算即可.
(2)根据v=
| △c |
| △t |
(3)影响化学反应速率的因素有:使用催化剂、改变温度、浓度、改变物质的表面积等;
(4)平衡常数为各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以k=
| c2(C) |
| c(A)?c2(B) |
(5)在开始到第4min建立平衡时,A物质的消耗量为0.6mol/L×1L=0.6mol,根据化学方程式计算即可.
解答:解:(1)在前4min内,A、B、C的浓度的变化量之比等于化学计量数之比,所以m:n:p=(1-0.4):(3-1.8):(1.2-0)=1:2:2,即,m=1、n=2、p=2;
故答案为:1;2;2;
(2)第0min到第2min:v(C)=
=0.2mol/(L?min),第2min到第4min:v(C)=
=0.4mol/(L?min),
故答案为:0.2mol/(L?min);0.4mol/(L?min);
(3)①在第0~2min内,A的浓度减小了0.2mol/l,在2~4min内A的浓度在原基础上减小了0.4mol/l,化学反应速率加快了,可以是使用催化剂或升高温度,
故答案为:使用催化剂或升高温度;
②第6min 到第8min,作为反应物,浓度应该是减小的趋势,但是B的浓度从1.8mol/l增加到了2.0mol/l,所以可知一定是加入了B物质,
故答案为:增加B的浓度;
③第8min到第9min时间段内,C作为生成物,它的浓度应是增大的趋势,但是数据表明,其浓度减小了,一定是减少了C的浓度,
故答案为:减小C的浓度;
(4)4min时,反应达平衡,此时c(A)=0.4mol/L,c(B)=1.8mol/L,c(C)=1.2mol/L,
所以平衡常数k=
=
=
mol-1?L,
故答案为:
mol-1?L;
(5)(4)根据热化学方程式,设:反应的焓变值为X,
A(g)+2B(g) 2C(g)△H=-XkJ/mol
2C(g)△H=-XkJ/mol
1mol XkJ
(1mol/l-0.4mol/l)×1L=0.6mol 235.92kJ
所以
=
,解得X=393.2,
所以反应热△H=-393.2kJ/mol,
故答案为:-393.2kJ/mol.
故答案为:1;2;2;
(2)第0min到第2min:v(C)=
| 0.4mol/L |
| 2min |
| 1.2mol/L-0.4mol/L |
| 4min-2min |
故答案为:0.2mol/(L?min);0.4mol/(L?min);
(3)①在第0~2min内,A的浓度减小了0.2mol/l,在2~4min内A的浓度在原基础上减小了0.4mol/l,化学反应速率加快了,可以是使用催化剂或升高温度,
故答案为:使用催化剂或升高温度;
②第6min 到第8min,作为反应物,浓度应该是减小的趋势,但是B的浓度从1.8mol/l增加到了2.0mol/l,所以可知一定是加入了B物质,
故答案为:增加B的浓度;
③第8min到第9min时间段内,C作为生成物,它的浓度应是增大的趋势,但是数据表明,其浓度减小了,一定是减少了C的浓度,
故答案为:减小C的浓度;
(4)4min时,反应达平衡,此时c(A)=0.4mol/L,c(B)=1.8mol/L,c(C)=1.2mol/L,
所以平衡常数k=
| c2(C) |
| c(A)?c2(B) |
| (1.2mol/L)2 |
| 0.4mol/L×(1.8mol/L)2 |
| 10 |
| 9 |
故答案为:
| 10 |
| 9 |
(5)(4)根据热化学方程式,设:反应的焓变值为X,
A(g)+2B(g)
 2C(g)△H=-XkJ/mol
2C(g)△H=-XkJ/mol1mol XkJ
(1mol/l-0.4mol/l)×1L=0.6mol 235.92kJ
所以
| 1mol |
| 0.6mol |
| XkJ |
| 235.92kJ |
所以反应热△H=-393.2kJ/mol,
故答案为:-393.2kJ/mol.
点评:本题考查了学生影响化学反应速率的因素和有关反应速率的计算,有一定的综合性.

练习册系列答案
相关题目
 CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol