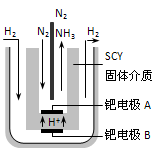
题目内容
合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1mol N2和2mol H2,在一定条件下,使之发生如下反应:N2+3H2?2NH3.
Ⅰ:若维持温度不变,且密闭容器的容积固定为1L.
(1)当此反应经过2min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2moL,则H2在2min内的平均反应速率为
(2)如果开始时,向该容器内加入0.5moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol、b mol、c mol,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示)
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1L随反应进行而改变.
(4)开始时加入1mol N2和2mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为
(甲)大于0.2mol (乙)等于0.2mol
(丙)小于0.2mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是
Ⅰ:若维持温度不变,且密闭容器的容积固定为1L.
(1)当此反应经过2min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2moL,则H2在2min内的平均反应速率为
0.15mol?L-1?min-1
0.15mol?L-1?min-1
.(2)如果开始时,向该容器内加入0.5moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2
0.5
0.5
mol和NH31.0
1.0
mol.(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol、b mol、c mol,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示)
a+
mol=1、b+
mol=2
| 1 |
| 2 |
| 3 |
| 2 |
a+
mol=1、b+
mol=2
.| 1 |
| 2 |
| 3 |
| 2 |
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1L随反应进行而改变.
(4)开始时加入1mol N2和2mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为
甲
甲
(选填一个编号)(甲)大于0.2mol (乙)等于0.2mol
(丙)小于0.2mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是
由于温度不变,随着反应的进行,容器的体积缩小,体系的压强比平衡(1)时增大,平衡向着正向移动
由于温度不变,随着反应的进行,容器的体积缩小,体系的压强比平衡(1)时增大,平衡向着正向移动
.分析:(1)根据化学反应方程式计算出消耗的氢气的物质的量,再计算出H2在2min内的平均反应速率;
(2)根据等效平衡,将氨气的物质的量全部转化为氮气、氢气,满足1mol N2和2mol H2;
(3)根据等效平衡,将氨气的物质的量a全部转化为氮气、氢气,满足1mol N2和2mol H2;
(4)恒压条件下反应,压强增大,合成氨的化学平衡向着正向移动.
(2)根据等效平衡,将氨气的物质的量全部转化为氮气、氢气,满足1mol N2和2mol H2;
(3)根据等效平衡,将氨气的物质的量a全部转化为氮气、氢气,满足1mol N2和2mol H2;
(4)恒压条件下反应,压强增大,合成氨的化学平衡向着正向移动.
解答:解:(1)反应混合物中NH3的物质的量为0.2moL,N2+3H2?2NH3,反应消耗了0.3mol氢气,H2在2min内的平均反应速率为:
=0.15mol?L-1?min-1,
故答案为:0.15mol?L-1?min-1;
(2)向该容器内加入0.5moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,即为等效平衡,所以需要满足,按照方程式的化学计量数将氨气的物质的量转化为氮气、氢气,物质的量分别为1mol N2和2mol H2,
先有0.5mol氮气,还差0.5mol氮气,需要氨气的物质的量为0.5mol×2=1mol;氨气转化为氢气的物质的量为1.5mol,还差0.5mol,
故答案为:0.5;1.0;
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol、b mol、c mol,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,即为等效平衡,将氨气的物质的量a全部转化为氮气、氢气,满足1mol N2和2mol H2,根据反应方程式N2+3H2?2NH3,cmol氨气转化为氮气、氢气物质的量为:
mol、
mol,a+
mol=1、b+
mol=2,
故答案为:a+
mol=1、b+
mol=2;
(4)由于温度不变,随着反应的进行,容器的体积缩小,体系的压强比平衡(1)时增大,平衡向着正向移动,平衡时氨气的物质的量大于0.2mol,
故答案为:甲;由于温度不变,随着反应的进行,容器的体积缩小,体系的压强比平衡(1)时增大,平衡向着正向移动.
| ||
| 2min |
故答案为:0.15mol?L-1?min-1;
(2)向该容器内加入0.5moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,即为等效平衡,所以需要满足,按照方程式的化学计量数将氨气的物质的量转化为氮气、氢气,物质的量分别为1mol N2和2mol H2,
先有0.5mol氮气,还差0.5mol氮气,需要氨气的物质的量为0.5mol×2=1mol;氨气转化为氢气的物质的量为1.5mol,还差0.5mol,
故答案为:0.5;1.0;
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol、b mol、c mol,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,即为等效平衡,将氨气的物质的量a全部转化为氮气、氢气,满足1mol N2和2mol H2,根据反应方程式N2+3H2?2NH3,cmol氨气转化为氮气、氢气物质的量为:
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:a+
| 1 |
| 2 |
| 3 |
| 2 |
(4)由于温度不变,随着反应的进行,容器的体积缩小,体系的压强比平衡(1)时增大,平衡向着正向移动,平衡时氨气的物质的量大于0.2mol,
故答案为:甲;由于温度不变,随着反应的进行,容器的体积缩小,体系的压强比平衡(1)时增大,平衡向着正向移动.
点评:本题考查了化学平衡的建立过程,注意等效平衡知识的理解及应用,本题难度中等.

练习册系列答案
相关题目
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,
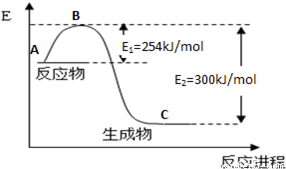
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: 。
(2)若已知下列数据:
|
化学键 |
H-H |
N≡N |
|
键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1 ,E2______,
△H (填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g); △H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)。
 M+D+E;②E+M=A+F+B
M+D+E;②E+M=A+F+B
 M+D+E;②E+M=A+F+B
M+D+E;②E+M=A+F+B
 2NH3(g);△H= -92.4 kJ/mol,
2NH3(g);△H= -92.4 kJ/mol,