题目内容
1. Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:Cu2S$→_{△}^{O}$Cu$\stackrel{焙}{→}$Cu2O$\stackrel{足量稀硫酸}{→}$A$\stackrel{操作1}{→}$B$\stackrel{蒸发结晶}{→}$胆矾
(1)Cu2S中铜元素的化合价为+1,火法炼铜的反应原理是Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2(用化学方程式表示).
(2)Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式:Cu2O+2H+=Cu+Cu2++H2O.
(3)若将A中单质反应,操作加入试剂最好是C.
A.加入适量的NaNO3 B.适量的 HNO3 C.适量的H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是0.018mol.
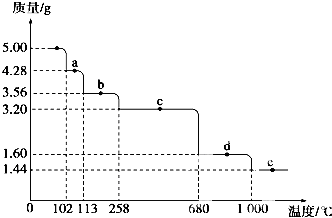
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O,e点的化学式Cu2O(计算过程略去).
分析 (1)化合物中各元素化合价的代数和为0;依据流程中Cu2S与O2反应得到Cu写出方程式即可;
(2)氧化亚铜和稀硫酸反应生成硫酸铜和铜,氧化铜和稀硫酸反应生成硫酸铜;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质;
(4)根据pH变化求出氢离子的物质的量变化,根据电解方程式计算转移的电子数;
(5)固体质量减少时,胆矾开始分解,根据减少的质量确定b、c段固体的化学式,从而确定发生的反应,根据最终剩余固体的质量采用假设的方法确定物质的组成.
解答 解:(1)化合物中各元素化合价代数和为0,O元素的化合价为-2价,所以Cu元素的化合价为+1价;Cu2S与O2反应得到Cu,Cu的化合价降低,故S的化合价升高,反应为:Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2,故答案为:+1;Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2;
(2)氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,生成红色物质的离子方程式为:Cu2O+2H+=Cu+Cu 2++H2O,
故答案为:Cu2O+2H+=Cu+Cu 2++H2O;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质,硝酸具有强氧化性但引进杂质离子,氢氧化钠没有氧化性且能引进杂质离子,双氧水具有强氧化性且不引进杂质离子,故选C;
故答案为:C;
(4)若硫酸铜溶液的体积为0.2L,电解溶液一段时间后溶液的pH由2变为1,则电解生成的氢离子为0.2L×(0.1-0.01)mol/L=0.018mol,
电极方程式为:2H2O-4e-=O2↑+4H+,则n(e-)=n(H+)=0.018mol;
故答案为:0.018mol;
(5)硫酸铜的物质的量=$\frac{5.00g}{250g/mol}$=0.02mol,根据胆矾的化学式知,结晶水的质量=0.02mol×5×18g/mol=1.8g,当固体质量减少1.8g时胆矾完全分解,258℃时,固体减少的质量=5.00g-3.20g=1.80g,所以C段固体是硫酸铜,b段物质减少的质量=5.00g-3.56g=1.44g,则失去的水的物质的量=$\frac{1.44g}{18g/mol}$=0.08mol,则固体中剩下水的物质的量为0.02mol×5-0.08mol=0.02mol,则b段固体的化学式为CuSO4.H2O,该反应方程式为:CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;
e点时固体质量为1.44g,铜的质量=0.02mol×64g/mol=1.28g,则另一种元素质量为1.44g-1.28g=0.16g,如果另一种元素是S元素,则硫的物质的量为$\frac{0.16g}{32g/mol}$=0.005mol,铜原子的物质的量为0.02mol,则Cu和S的个数比为4:1,不符合化合价原则,所以另一种元素是氧元素,其物质的量为$\frac{0.16g}{16g/mol}$=0.01mol,所以其化学式为Cu2O,
故答案为:CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;Cu2O.
点评 本题考查了物质的量的有关计算,结合元素化合价变化及氧化还原反应来分析解答,难点是(4)题,根据固体质量变化确定每一段物质的组成,从而确定每一段发生的反应,难度中等.

| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
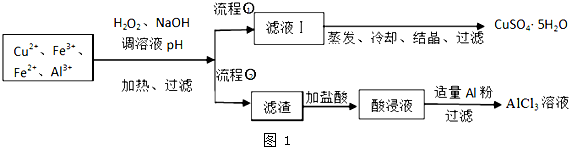
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
(1)加入H2O2的作用是将Fe2+氧化为Fe3+,欲使制取的CuSO4•5H2O晶体较为纯净,pH至少应调至5.0;
(2)写出H2O2与Fe2+离子方程式H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)流程②中加入适量Al粉起的作用是与酸浸液中Fe3+和H+反应生成Al3+;
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3不能(填:能或不能),原因是直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝;
(5)取体积为V(L)的酸浸液,向其中滴加a mol•L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图2.请用V1、V2、V3表示所取的酸浸液中n(Fe3+):n(Al3+)$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$.
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 元素周期表根据相对原子质量从小到大的顺序排列 | |
| C. | 现常见的元素周期表有七个横行,分为七个周期,有18个纵行,分为16个族 | |
| D. | 每一周期都是从金属元素开始,非金属元素结束 |
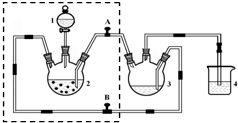 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: