题目内容
10.向盛有Cl2的六个集气瓶甲、乙、丙、丁、戊、己中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙、丁、戊、己注入的液体分别是( )①AgNO3溶液 ②NaOH溶液 ③水 ④淀粉-KI溶液 ⑤FeCl2与KSCN混合液 ⑥NaBr溶液

| A. | ④①②⑥⑤③ | B. | ⑥①③④②⑤ | C. | ⑥③②④①⑤ | D. | ②①③④⑥⑤ |
分析 氯气为黄绿色气体,能溶于水,溶于水得到氯水,氯水因为溶解氯气显浅黄绿色;氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠和水;氯气与水反应生成盐酸和次氯酸,次氯酸具有强氧化性和漂白性,盐酸与硝酸银反应生成氯化银白色沉淀,以此解答该题.
解答 解:氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠和水,所以氯气被氢氧化钠吸收,溶液为无色,故甲中液体为氢氧化钠溶液;
氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应生成氯化银白色沉淀,甲和乙中,只有乙出现了白色的沉淀,所以乙中液体为硝酸银溶液;
氯气为黄绿色气体,能溶于水,溶于水得到氯水,氯水因为溶解氯气显浅黄绿色,三个集气瓶中只有丙颜色为浅黄绿色,所以丙中液体为水;
氯气可与KI反应生成碘,淀粉遇碘便蓝色,丁中为淀粉-KI溶液;
氯气可氧化溴化钠生成溴,溶液呈橙黄色,则戊中为NaBr溶液;
己中溶液呈红色,应加入FeCl2与KSCN混合液,生成Fe(SCN)3,
故选D.
点评 本题综合考查氯水的组成和性质,为高频考点,侧重考查学生的分析能力和实验能力,注意把握氯水的组成和重要成分的性质,难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
6.下列说法正确的是( )
| A. | 1mol蔗糖可以水解生成2mol葡萄糖 | |
| B. | 乙醇发生消去反应可制得乙烯 | |
| C. | (CH3)2CHCH(CH3)2的名称是2,3-甲基丁烷 | |
| D. | 棉,麻,丝,毛燃烧后都只生成CO2和H2O |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 向氯水中加食盐不利于氯气的溶解 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 高压有利于合成氨的反应 |
18.化学“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动.下列利用家庭日常生活用品进行的实验都能达到如期目的一组是( )
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
| A. | ①②⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑥ | D. | ①②③④⑥ |
5.某无色溶液中可能存在如下几种阴阳离子:
现对该溶液样品进行以下研究:
Ⅰ.向溶液中加入稀盐酸后有无色气体生成,该气体遇空气变成红棕色;
Ⅱ.若向Ⅰ所得溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅲ.若向Ⅰ所得溶液中加入过量NaOH浓溶液并加热,产生有刺激性气味的气体,最终溶液无沉淀生成;
Ⅳ.向Ⅲ所得溶液中通入过量的CO2气体,有白色絮状沉淀生成.
根据上述实验,回答下列问题:
(1)该溶液中一定存在的阳离子为Al3+、NH4+,一定不存在的离子为Fe2+、Ba2+、CO32-.
(2)检验溶液中可能还存在的阳离子的方法为用洁净铂丝蘸取原溶液进行焰色反应,若火焰呈黄色,原溶液中存在Na+,若不出现黄色,则不存在Na+.
(3)写出实验Ⅰ发生反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O.
(4)写出实验Ⅳ中生成白色絮状沉淀的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
| 阳离子 | Al3+、Fe2+、Ba2+、Na+、NH4+ |
| 阴离子 | Cl-、CO32-、SO42-、NO3-、I- |
Ⅰ.向溶液中加入稀盐酸后有无色气体生成,该气体遇空气变成红棕色;
Ⅱ.若向Ⅰ所得溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅲ.若向Ⅰ所得溶液中加入过量NaOH浓溶液并加热,产生有刺激性气味的气体,最终溶液无沉淀生成;
Ⅳ.向Ⅲ所得溶液中通入过量的CO2气体,有白色絮状沉淀生成.
根据上述实验,回答下列问题:
(1)该溶液中一定存在的阳离子为Al3+、NH4+,一定不存在的离子为Fe2+、Ba2+、CO32-.
(2)检验溶液中可能还存在的阳离子的方法为用洁净铂丝蘸取原溶液进行焰色反应,若火焰呈黄色,原溶液中存在Na+,若不出现黄色,则不存在Na+.
(3)写出实验Ⅰ发生反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O.
(4)写出实验Ⅳ中生成白色絮状沉淀的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
15.下列离子方程式中正确的是( )
| A. | 工业上粗硅的制备:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | Cu2O与稀H2SO4反应:Cu2O+2H+═2Cu++H2O | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O+CO32- |
19.“塑胶”跑道是由聚氨酯橡胶等材料建成.聚氨酯橡胶属于( )
| A. | 金属材料 | B. | 无机非金属材料 | ||
| C. | 有机高分子材料 | D. | 传统无机非金属材料 |
20.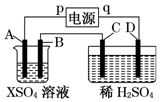 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
仔细分析以上实验数据,请说出变化的可能原因是开始时C、D两极气体体积比为1:3,10分钟时约为1:2,说明开始时氧气溶解于溶液中.
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
 .
.