题目内容
Ⅰ.如图表示各物质之间的转化关系(部分产物略去).已知D、E、Z是中学化学常见单质,其他都是化合物.Z、Y是氯碱工业产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.请回答下列问题:
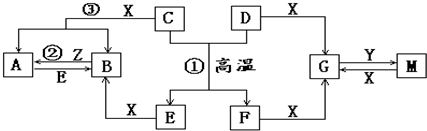
(1)A晶体的熔点282℃、沸点315℃,加热至100℃左右会升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂则A晶体属于 晶体,升华时克服的作用力类型是 .
(2)写出反应①的化学方程式: .写出反应③的离子方程式: ;若将C溶于稀硝酸中,试写出其化学反应方程式 .
Ⅱ.短周期元素X、Y、Z、T、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,T单质可制成半导体材料,W与X属于同一主族.
(1)X、Y、Z的简单离子半径由大到小的顺序是 (填写离子符号).
(2)T、W的气态氢化物中较稳定的是 (填化学式).
(3)Y17Z12是一种潜在的贮氢材料,在Ar的保护下,将Y、Z的单质在一定温度下熔炼可制得该材料.该贮氢材料在一定条件下完全吸氢的反应的化学方程式为:
Y17Z12+17H2=17YH2+12Z.生成的混合物(用M表示)在一定条件下可释放出H2.
①熔炼制备该材料时通入Ar的目的是
②在足量的6.0mol/L的盐酸中,M能完全释放出H2.36.6gY17Z12完全吸氢后得到的混合物M与足量上述盐酸完全反应,释放出的H2在标准状况下的体积为 L.

(1)A晶体的熔点282℃、沸点315℃,加热至100℃左右会升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂则A晶体属于
(2)写出反应①的化学方程式:
Ⅱ.短周期元素X、Y、Z、T、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,T单质可制成半导体材料,W与X属于同一主族.
(1)X、Y、Z的简单离子半径由大到小的顺序是
(2)T、W的气态氢化物中较稳定的是
(3)Y17Z12是一种潜在的贮氢材料,在Ar的保护下,将Y、Z的单质在一定温度下熔炼可制得该材料.该贮氢材料在一定条件下完全吸氢的反应的化学方程式为:
Y17Z12+17H2=17YH2+12Z.生成的混合物(用M表示)在一定条件下可释放出H2.
①熔炼制备该材料时通入Ar的目的是
②在足量的6.0mol/L的盐酸中,M能完全释放出H2.36.6gY17Z12完全吸氢后得到的混合物M与足量上述盐酸完全反应,释放出的H2在标准状况下的体积为
考点:无机物的推断
专题:推断题
分析:Ⅰ.图中D、E、Z是单质,其余均是化合物.且知E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al2O3;Z、Y是氯碱工业的产品,由图中Al、Al2O3和Y反应可推断,Y为NaOH;得到Z为Cl2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO2,M为AlCl3,B为FeCl2,A为FeCl3,则C为Fe3O4,然后结合物质的性质及化学反应原理来解答;
Ⅱ.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,T单质可制成半导体材料,T为Si元素,则Z为Al,以此解答该题.
Ⅱ.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,T单质可制成半导体材料,T为Si元素,则Z为Al,以此解答该题.
解答:
解:Ⅰ.图中D、E、Z是单质,其余均是化合物.且知E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al2O3;Z、Y是氯碱工业的产品,由图中Al、Al2O3和Y反应可推断,Y为NaOH;得到Z为Cl2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO2,M为AlCl3,B为FeCl2,A为FeCl3,则C为Fe3O4,
(1)FeCl3晶体的熔点282℃、沸点315℃,加热至100℃左右会升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,应为分子晶体,升华时克服的作用力类型为分子间作用力(范德华力),
故答案为:分子;分子间作用力(范德华力);
(2)反应①为铝热反应,方程式为8Al+3Fe3O4
4Al2O3+9Fe,反应③为Fe3O4和酸的反应,离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,若将Fe3O4溶于稀硝酸中,因含有+2价铁,则发生氧化还原反应,反应的化学方程式为3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O,
故答案为:8Al+3Fe3O4
4Al2O3+9Fe;Fe3O4+8H+=Fe2++2Fe3++4H2O;3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O;
Ⅱ.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,T单质可制成半导体材料,T为Si元素,则Z为Al,
(1)O2-、Mg2+、Al3+ 具有相同的核外电子排布,核电荷数越大,则离子半径越小,应为O2->Mg2+>Al3+,故答案为:O2->Mg2+>Al3+;
(2)非金属性S>Si,元素的非金属性越强,对应的氢化物越稳定,则H2S较稳定,故答案为:H2S;
(3)①Mg、Al 是活泼金属易被氧化,故熔炼制备镁铝合金(Mg17Al12)时常需通入氩气作保护气,目的是防止Mg、Al被空气氧化,
故答案为:防止Mg、Al被空气氧化;
②36.6gMg17Al12的物质的量为
=0.05mol,反应的方程式为Mg17Al12+17H2═17MgH2+12Al,根据方程式知,1molMg17Al12完全吸氢后生成17molMgH2和12molAl,根据原子守恒知与酸反应后吸收的氢气完全被放出,吸收的氢气的物质的量是17mol,镁与盐酸完全反应放出n(H2)=n(Mg)=17mol,12mol铝与足量盐酸反应放出的n(H2)=1.5n(Al)=18mol,所以共放出n(H2)=17mol+17mol+18mol=52mol,
则36.6gMg17Al12与盐酸反应生成氢气的体积为0.05×52mol×22.4/mol=58.24L,
故答案为:58.24.
(1)FeCl3晶体的熔点282℃、沸点315℃,加热至100℃左右会升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,应为分子晶体,升华时克服的作用力类型为分子间作用力(范德华力),
故答案为:分子;分子间作用力(范德华力);
(2)反应①为铝热反应,方程式为8Al+3Fe3O4
| ||
故答案为:8Al+3Fe3O4
| ||
Ⅱ.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,T单质可制成半导体材料,T为Si元素,则Z为Al,
(1)O2-、Mg2+、Al3+ 具有相同的核外电子排布,核电荷数越大,则离子半径越小,应为O2->Mg2+>Al3+,故答案为:O2->Mg2+>Al3+;
(2)非金属性S>Si,元素的非金属性越强,对应的氢化物越稳定,则H2S较稳定,故答案为:H2S;
(3)①Mg、Al 是活泼金属易被氧化,故熔炼制备镁铝合金(Mg17Al12)时常需通入氩气作保护气,目的是防止Mg、Al被空气氧化,
故答案为:防止Mg、Al被空气氧化;
②36.6gMg17Al12的物质的量为
| 36.6g |
| 732g/mol |
则36.6gMg17Al12与盐酸反应生成氢气的体积为0.05×52mol×22.4/mol=58.24L,
故答案为:58.24.
点评:本题考查无机物的推断,为高频考点,把握物质的性质及转化关系推断物质为解答的关键,涉及氧化还原反应、离子半径大小比较以及化学方程式的计算等知识,综合性较强,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列说法正确的是( )
| A、蛋白质、纤维素、油脂、PVC、淀粉都是高分子化合物 |
| B、油脂的皂化和硬化都是取代反应 |
| C、饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
| D、红外光谱仪、核磁共振仪、质谱仪可用于有机化合物结构的分析 |
反应A+B═2C,在反应过程中,断裂1mol A中的化学键消耗的能量为Q1kJ,断裂1mol B中的化学键消耗的能量为Q2kJ,形成1mol C中的化学键释放的能量为Q3kJ;1mol A所含化学能为E1kJ,1mol B所含化学能E2kJ,1molC 所含化学能E3kJ.下列说法中一定正确的是( )
| A、若Q1+Q2>Q3,则反应为放热反应 |
| B、若Q1+Q2<2Q3,则反应为放热反应 |
| C、若E1+E2>E3,则反应为放热反应 |
| D、若E1+E2>E3,则反应为吸热反应 |
 我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧.”回顾苯的结构的探索历程,曾有人提出两种立体结构就上述两种立体结构回答下列有关问题:
我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧.”回顾苯的结构的探索历程,曾有人提出两种立体结构就上述两种立体结构回答下列有关问题: 如图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下:
如图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下: