题目内容
25℃时,在0.1mol?L-1的下列溶液中,微粒的物质的量浓度关系正确的是( )
| A、NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||||
B、NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO
| ||||
| C、CH3COONa溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||||
D、Na2CO3溶液中:2c(Na+)=c(CO
|
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、氯化铵溶液中,铵离子部分水解,溶液中铵离子浓度小于氯离子浓度;
B、硫酸氢钠溶液为酸性溶液,亚硫酸氢根离子的电离程度大于其水解程度;
C、醋酸钠溶液中一定满足电荷守恒,根据电荷守恒进行判断;
D、根据物料守恒可知,
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3).
B、硫酸氢钠溶液为酸性溶液,亚硫酸氢根离子的电离程度大于其水解程度;
C、醋酸钠溶液中一定满足电荷守恒,根据电荷守恒进行判断;
D、根据物料守恒可知,
| 1 |
| 2 |
解答:
解:A、NH4Cl溶液中,铵离子部分水解,溶液显示酸性,铵离子浓度减小,所以正确的离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B、NaHSO3溶液(呈酸性)中,HSO3-的电离程度大于其水解程度,亚硫酸根离子浓度大于亚硫酸浓度,溶液中离子浓度关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故B正确;
C、CH3COONa溶液中,根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D、碳酸钠溶液中,根据物料守恒可知:
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选BC.
B、NaHSO3溶液(呈酸性)中,HSO3-的电离程度大于其水解程度,亚硫酸根离子浓度大于亚硫酸浓度,溶液中离子浓度关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故B正确;
C、CH3COONa溶液中,根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D、碳酸钠溶液中,根据物料守恒可知:
| 1 |
| 2 |
故选BC.
点评:本题考查了溶液中离子浓度大小比较、盐的水解、弱电解质的电离等知识,题目难度中等,注意掌握溶液中离子浓度大小的方法,注意电荷守恒、物料守恒在比较离子浓度大小中的应用.

练习册系列答案
相关题目
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示溶液中c(CH3COO-)约为10-3 mol/L | ||
| B、b点表示的溶液中c(Na+)>c(CH3COO-) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、d点表示的溶液中
|
下列离子方程式不正确的是( )
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、醋酸钠的水解:CH3COO-+H3O+?CH3COOH+H2O |
D、苯酚钠溶液中通入CO2气体: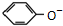 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
下列实验装置图合理的是( )
A、 如图装置可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 |
B、 如图装置能构成锌铜原电池 |
C、 如图装置可用于粗铜的电解精炼 |
D、 如图装置可用于在实验室测定中和反应的反应热 |
用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是( )
| A、稀HCl溶液 |
| B、稀Na2SO4溶液 |
| C、CuCl2溶液 |
| D、酸性AgNO3溶液 |
下列各组离子在溶液中能大量共存的是( )
| A、K+、Na+、SO42-、CO32- |
| B、NH4+、Na+、SO42-、OH- |
| C、H+、K+、HCO3-、Cl- |
| D、Al3+、K+、OH-、NO3- |
 某不饱和烃,经与氢气加成反应可得到结构简式为(如图)的烷烃,则此不饱和烃若为烯烃可能的结构简式有
某不饱和烃,经与氢气加成反应可得到结构简式为(如图)的烷烃,则此不饱和烃若为烯烃可能的结构简式有