题目内容
16.[化学一物质结构与性质]据媒体报道,佐治亚大学的科研人员制备了一种以氧化铁为核,以二氧化钛为壳的核一壳纳米结构催化剂,该催化剂可以更高效地把太阳能转变为化学能,为未来清洁、可再生能源的发展提供了新的研究方向.制备金属钛的一种流程如下:
[钙钛矿]$\underset{\stackrel{硫酸}{→}}{过滤}$[硫酸氧钛溶液]$\underset{\stackrel{水/△}{→}}{过滤}$[H2TiO3]$\stackrel{焙烧}{→}$[TiO2]$\underset{\stackrel{C、C{l}_{2}}{→}}{高温}$[TiCl4]$\underset{\stackrel{Mg/Ar}{→}}{高温}$[Ti]
(1)基态钛原子的价电子排布图为
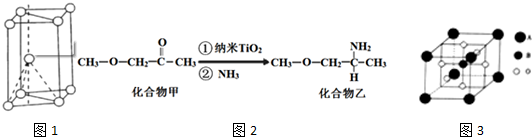
 ,其原子核外共有22种运动状态不相同的电子.金属钛的晶胞结构如图1所示,其堆积方式为六方最密堆积.
,其原子核外共有22种运动状态不相同的电子.金属钛的晶胞结构如图1所示,其堆积方式为六方最密堆积.(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l>l-b>b-b(l为孤对电子对,b为键合电子对),则H2O中的H-O-H键角D(填字母).
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28′,但小于109°28′
(3)已知TiCl4在通常情况下是无色液体,熔点为-25℃,沸点为136℃,则TiCl4为分子晶体.
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2.化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键,而化合物甲分子间不能形成氢键.化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为N>O>C.
(5)钙钛矿晶体的结构如图3所示.钛离子位于立方晶胞的顶角,被12个氧离子包围;钛离子位于立方晶胞的体心,被6个氧离子包围成配位八面体,钙钛矿晶体的化学式为CaTiO3.若该晶胞的边长为apm,则钙钛矿晶体的密度为$\frac{136}{(a×1{0}^{-10})^{3}{N}_{A}}$g•cm-3(只要求列算式,不必计算出数值).
分析 钛铁矿(主要成分为 FeTiO3,可表示为 FeO•TiO2)加入硫酸溶解过滤得到滤液硫酸氧钛溶液[TiOSO4],加热促进Ti4+水解生成H2TiO3,过滤并煅烧得到TiO2,TiO2和C、Cl2在高温条件下生成TiCl4和CO,TiCl4在稀有气体的环境中高温条件下被镁还原生成Ti和MgCl2,
(1)Ti原子核电荷数为22,价电子排布式为3d24s2,据此可写出价电子排布图,结合原子核外没有运动状态完全相同的电子,判断Ti原子核外不同运动状态的电子数,金属钛晶胞结构为二层相互错开,第三层正对第一层的方式堆积而成的;
(2)水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据l-l>l-b>b-b,应有∠H-O-H<109°28′;
(3)TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为晶体熔、沸点较低,即分子间作用力低;
(4)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键,故分子间作用力比化合物甲强;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,第一电离能是基态原子失去第一电子的能力,N原子的p轨道上有3个电子,为半充满结构,第一电离能相对较大;
(5)立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子,包围着中心的钙离子,钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,可以根据晶胞的均摊原则确定晶胞的化学式,根据晶胞的体积及晶胞的质量,依据ρ=$\frac{m}{v}$计算晶体密度.
解答 解:钛铁矿(主要成分为 FeTiO3,可表示为 FeO•TiO2)加入硫酸溶解过滤得到滤液硫酸氧钛溶液[TiOSO4],加热促进Ti4+水解生成H2TiO3,过滤并煅烧得到TiO2,TiO2和C、Cl2在高温条件下生成TiCl4和CO,TiCl4在稀有气体的环境中高温条件下被镁还原生成Ti和MgCl2,
(1)钛原子的价电子排布式为3d24s2,则价电子排布图为 ,钛原子的核电荷数为22,其核外共有22个运动状态不同的电子,晶体钛为六方最密堆积形,
,钛原子的核电荷数为22,其核外共有22个运动状态不同的电子,晶体钛为六方最密堆积形,
故答案为: ;22;六方最密;
;22;六方最密;
(2)根据价层电子对之间的斥力大小顺序:l-l>l-b>b-b(l为孤对电子对,b为键合电子对),应有∠H-O-H<109°28′,选项D正确,
故答案为:D;
(3)TiCl4是共价型化合物,熔沸点较低,应为分子晶体,
故答案为:分子;
(4)化合物乙因分子间存在氢键,则化合物乙的沸点比化合物甲高,化合物乙中C、N、O三原子均为sp3杂化,三者的第一电离能因N原子的2p轨道半充满相对稳定较大,实际顺序为N>O>C,
故答案为:化合物乙分子间形成氢键,而化合物甲分子间不能形成氢键;N>O>C;
(5)钙离子位于立方晶胞的体心,被12个氧离子包围;钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×$\frac{1}{4}$=3,则晶胞的化学式为CaTiO3;该晶胞的边长为apm,晶胞的体积为(a×10-10)3cm3,1mol晶胞的质量为136g,1mol晶胞的体积为NA×(a×10-10)3cm3,晶体的密度ρ=$\frac{m}{v}$=$\frac{136}{(a×1{0}^{-10})^{3}{N}_{A}}$g.cm-3,
故答案为:12;6;CaTiO3; $\frac{136}{(a×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题以金属钛的工业制备流程为载体,考查钛原子的结构特点及钛酸钙晶胞结构及相关计算,属基础考查,中等难度.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
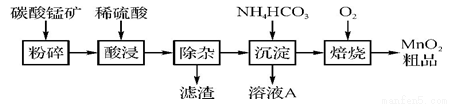
各地期末复习特训卷系列答案工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下图:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
问答下列问题:
(1) 酸浸前将碳酸锰矿粉碎的作用是 。
(2) 酸浸后的溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其反应的离子方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3) 从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4) MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式: 。
| A. | 若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$ amol≤n≤$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$amol |
| A. | 微粒半径:Y>Z>X>W | |
| B. | 最高价氧化物的水化物的酸性:W<Z | |
| C. | 简单氢化物的稳定性:W>Z>X | |
| D. | X与W、Y形成的化合物中,其化学键类型相同 |
| A. | CaCl2 | B. | Ba(OH)2 | C. | H2O2 | D. | Na2O2 |
| A. | 淀粉、油脂和蛋白质都是高分子化合物,且它们均为混合物 | |
| B. | 煤、石油和天然气都是化石燃料,且它们均不能再生 | |
| C. | 果糖和葡萄糖不能发生水解反应,蔗糖和麦芽糖都能发生水解反应 | |
| D. | 乙酸和葡萄糖都能不新制的 Cu(OH)2悬浊液反应,且反应类型均为氧化反应 |

 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体 .
. 由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是 .
. .
. 互为同分异构体,且一溴代物只有两种的芳香烃的名称1,3,5-三甲基苯.写出生成这两种一溴代物所需要的反应试剂和反应条件催化剂和液溴、光照和溴蒸气.
互为同分异构体,且一溴代物只有两种的芳香烃的名称1,3,5-三甲基苯.写出生成这两种一溴代物所需要的反应试剂和反应条件催化剂和液溴、光照和溴蒸气. .
. 的属于芳香烃的同分异构体的同系物制备
的属于芳香烃的同分异构体的同系物制备 的合成路线,(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…目标产物):
的合成路线,(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…目标产物): .
.