题目内容
3.NA为阿佛加德罗常数的值,下列说法正确的是( )| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 在标准状况下22.4L SO3有4NA个原子 | |
| C. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| D. | 7.8g Na2S和Na2O2的混合物中所含离子数为0.3 NA |
分析 A、一水合氨为弱电解质;
B、标况下三氧化硫为固体;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
D、Na2S和Na2O2的摩尔质量均为78g/mol,且两者均由2个阳离子和1个阴离子构成.
解答 解:A、一水合氨为弱电解质,不能完全电离,故溶液中的铵根离子的个数小于0.1NA个,故A错误;
B、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的原子个数,故B错误;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故分子个数小于2NA个,故C错误;
D、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,且两者均由2个阳离子和1个阴离子构成,故0.1mol混合物中含有的离子个数为0.3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
13.下列元素原子半径最大的是( )
| A. | Na | B. | Cl | C. | F | D. | Li |
14.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
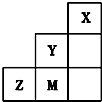

| A. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 稳定性:HY<HM | |
| D. | 非金属性:Y>M>Z |
11.下列实验操作中,不正确的是( )
| A. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 | |
| B. | 蒸馏时,冷却水从冷凝管的下口通入,上口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用四氯化碳萃取碘水中的碘单质 |
18.分子式为C9H10O2的含有一价苯环的所有酯类同分异构体有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
8.某原子核外M层上的电子数是K层电子数的三倍,则该元素的核电荷数为(( )
| A. | 14 | B. | 8 | C. | 16 | D. | 12 |
15.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 体积和氢离子浓度都相同的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 | |
| D. | 等浓度等体积的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 |
12.下列措施中使得水的电离平衡H2O?H++OH-正方向移动的是( )
| A. | 滴入盐酸 | B. | 滴入氢氧化钠溶液 | ||
| C. | 加热 | D. | 加水 |
13.硅在自然界中只以化合态形式存在,如铁矿石中的硅主要以脉石(SiO2)的形式存在,炼铁时为了除去脉石,向炼铁高炉中加入石灰石.该过程不可能涉及的化学反应是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2 | ||
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑ | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |