题目内容
11.关于FeCl3溶液水解的错误说法是( )| A. | FeCl3水解使溶液呈酸性,并能起净水作用,使水中悬浮的杂质沉降 | |
| B. | 浓度为5mol•L-1和0.5mol•L-1的两种FeCl3溶液,其它条件相同时,Fe3+离子的水解程度前者比后者低 | |
| C. | 加热FeCl3溶液并蒸干,再灼烧,此时得到的固体是无水氯化铁 | |
| D. | 为了抑制Fe3+的水解,更好地保存FeCl3溶液,应向其中加入少量的盐酸 |
分析 Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,结合影响盐类水解的因素解答该题.
解答 解:A.氯化铁为强酸弱碱盐,水解呈酸性,生成具有吸附性的氢氧化铁胶体,可用于除杂,故A正确;
B.溶液浓度越大,水解程度越小,故B正确;
C.氯化铁水解生成氢氧化铁和盐酸,盐酸挥发,灼烧生成氧化铁,故C错误;
D.Fe3+易水解,水解生成H+,保存溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊,故D正确.
故选C.
点评 本题考查盐类水解的原理及应用,为高频考点,题目难度不大,注意把握水解原理,学习中注重相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列每组均有三种等物质的量浓度、等体积的溶液,若将它们混合起来,无沉淀物产生的是( )
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
6.下列离子水解的离子方程式中正确的是( )
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
16.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最高正化合价与最低负化合价的绝对值相等;M是地壳中含量仅次于氧元素的非金属元素;L的最简单气态氢化物甲能使湿润的红色石蕊试纸变蓝.
(1)M的原子结构示意图为 ; 元素T最高价氧化物对应水化物化学式是Cl2O7.
; 元素T最高价氧化物对应水化物化学式是Cl2O7.
(2)写出J和氧形成的一种酸性氧化物的电子式 ,含有共价键是极性键(填极性键或非极性键).
,含有共价键是极性键(填极性键或非极性键).
(3)写出能说明T非金属性比R强的反应的化学方程式Cl2+H2S=2HCl+S
(4)在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
| J | |||
| R |
 ; 元素T最高价氧化物对应水化物化学式是Cl2O7.
; 元素T最高价氧化物对应水化物化学式是Cl2O7.(2)写出J和氧形成的一种酸性氧化物的电子式
 ,含有共价键是极性键(填极性键或非极性键).
,含有共价键是极性键(填极性键或非极性键).(3)写出能说明T非金属性比R强的反应的化学方程式Cl2+H2S=2HCl+S
(4)在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
18.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 23g钠的原子最外层电子数为2NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4L乙烷的分子数为NA | |
| D. | 1mol甲基所含质子数为10NA |
 (1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.
(1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图. .
.

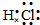 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)
,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)