题目内容
12.下列反应中,在原理上可以设计成原电池的是( )| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 铝片与浓硫酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
分析 设计的化学反应必须是能够自发进行的氧化还原反应,且该反应必须是放热反应,据此对各选项进行判断.
解答 解:A.Ba(OH)2•8H2O与NH4Cl的反应不是氧化还原反应,不能设计成原电池,故A错误;
B.Al片与浓硫酸在常温下发生钝化,不能设计成原电池,故B错误;
C.甲烷与氧气的反应为自发进行的氧化还原反应,且为放热反应,能够设计成原电池,故C正确;
D.石灰石分解的反应不是氧化还原反应,不能设计成原电池,故D错误;
故选C.
点评 本题考查了原电池的设计,题目难度不大,明确原电池的构成条件及反应必须是放热的氧化还原反应是解本题的关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.芳香族化合物G与 互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
 互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
20.下列离子方程式中,正确的是( )
| A. | 稀硫酸与NaOH溶液反应:2H++OH-=H2O | |
| B. | AgNO3溶液与NaCl溶液反应:Ag++Cl-=AgCl↓ | |
| C. | CaCO3与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | Fe片插入FeCl3溶液中:Fe+Fe3+=2Fe2+ |
7. Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
(1)该小组在设计方案时,考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响.
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?一般加入催化剂、反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢).
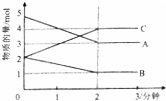
Ⅱ.反应在体积为5L的恒容密闭容器中进行,在0-3分钟内个物质的量的变化情况如图所示,(A,B,C均为气体,且A气体有颜色).
(3)该反应的化学方程式为2A+B?2C.
(4)反应开始至2分钟时,B的平均速率为0.1mol/(L•min).
(5)能说明该反应已达到平衡状态的是cd.
a.v(A)=2v(B) b.容器内各物质的物质的量相等 c.v逆(A)=v正(C) d.容器内气体的颜色保持不变.
 Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)  | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?一般加入催化剂、反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢).
Ⅱ.反应在体积为5L的恒容密闭容器中进行,在0-3分钟内个物质的量的变化情况如图所示,(A,B,C均为气体,且A气体有颜色).
(3)该反应的化学方程式为2A+B?2C.
(4)反应开始至2分钟时,B的平均速率为0.1mol/(L•min).
(5)能说明该反应已达到平衡状态的是cd.
a.v(A)=2v(B) b.容器内各物质的物质的量相等 c.v逆(A)=v正(C) d.容器内气体的颜色保持不变.
17.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | 稀有气体原子的最外层电子数都为8 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第三周期第ⅡA族 |
4.氧杂环丙烷的结构如图所示,下列说法正确的是( )
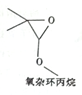

| A. | 该有机物能与金属钠反应 | |
| B. | 该有机物的分子式为C5H9O2 | |
| C. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 | |
| D. | 该有机物的同分异构体(不考虑立体异构体)中,能水解生成羧酸与醇的物质共有9种 |
1.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_8^{18}O$ | |
| D. | 丙烯的结构简式为:CH3CHCH2. |