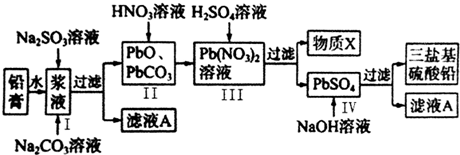
题目内容
10.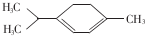 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 分子中氢原子的种类等于一氯取代物的种类,据此解答.
解答 解:该分子不对称, 分子中7种氢原子,一氯代物有7种.
分子中7种氢原子,一氯代物有7种.
故选C.
点评 本题考查一氯代物的书写,题目难度不大,正确判断等效氢原子数目为解答本题的关键.

练习册系列答案
相关题目
1.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
2.NA为阿伏加德罗常数的数值.下列说法不正确的是( )
| A. | 标准状况下,2.24L甲烷中含氢原子数为0.4NA | |
| B. | 0.3molNO2与足量的水反应转移电子数为0.2NA | |
| C. | 1L0.1mol•L-1Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 5.6g铁完全溶于足量稀硝酸,转移电子数为0.3NA |
10.进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是 ( )
| A. | (CH3)2 CH CH2CH2CH3B | B. | (CH3 CH2)2 CHCH3 | ||
| C. | (CH3)2 CH CH (CH3)2 | D. | (CH3)3 C CH2CH3 |
11.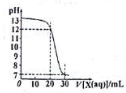 如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
 如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )| A | B | C | D | |
| X/mol/L | 0.09 | 0.03 | 0.04 | 0.12 |
| Y/mol/L | 0.03 | 0.09 | 0.12 | 0.04 |
| A. | A | B. | B | C. | C | D. | D |