题目内容
8.下列电子式表示正确的是( )| A. | Cl2: | B. | NaCl: | C. | NaOH: | D. | H2O: |
分析 A.氯气的电子式中,氯原子最外层达到8电子稳定结构,氯气分子中存在氯氯单键;
B.氯化钠为离子化合物,电子式为阴阳离子的形式;
C.氢氧化钠为离子化合物,应该为阴阳离子的形式;
D.水是共价化合物,原子间通过共用电子对形成化学键.
解答 解:A.氯气的电子式中,氯原子最外层达到8电子稳定结构,氯气分子中存在氯氯单键,氯气的电子式为: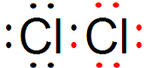 ,故A错误;
,故A错误;
B.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故B正确;
,故B正确;
C.氢氧化钠为离子化合物,NaOH的电子式: ,故C错误;
,故C错误;
D.水是共价化合物,原子间通过共用电子对形成化学键,其电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
18.下列晶体中既有离子键又有非极性键的是( )
| A. | NaOH | B. | Na2O2 | C. | CaCl2 | D. | H2O2 |
19.X元素原子的质量数为m,核内中子数为n,则Wg X2+离子含有的电子的物质的量约为( )
| A. | $\frac{m+n+2}{w}$mol | B. | $\frac{m-n+2}{m}$ mol | C. | $\frac{m+n-2}{m}$ mol | D. | $\frac{W(m-n-2)}{m}$mol |
16.在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率高 | |
| C. | t1至t2时刻该反应的速率为3mol•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
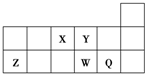
3.下表是元素周期表的一部分,表中的每个字母代表一种短周期元素.
(1)a元素和c元素可以形成的气体,其化学式为NH3;
(2)e的元素符号是Na;
(3)b元素原子的最外层电子数为4;
(4)b、c、d三种元素的非金属性逐渐增强(填“减弱”或“增强”);
(5)d元素和f元素均可形成气态氢化物,其稳定性为H2d大于H2f (填“大于”或“小于”).
(6)上述七种元素的最高价氧化物的水合物中,碱性最强的是NaOH,酸性最强的是HClO4,既有酸性又有碱性的是Al(OH)3(写化学式)
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | g | f | |||||
(2)e的元素符号是Na;
(3)b元素原子的最外层电子数为4;
(4)b、c、d三种元素的非金属性逐渐增强(填“减弱”或“增强”);
(5)d元素和f元素均可形成气态氢化物,其稳定性为H2d大于H2f (填“大于”或“小于”).
(6)上述七种元素的最高价氧化物的水合物中,碱性最强的是NaOH,酸性最强的是HClO4,既有酸性又有碱性的是Al(OH)3(写化学式)
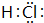 ,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.
,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.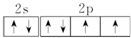 ,该元素的名称是氧;
,该元素的名称是氧;