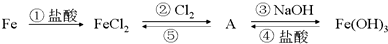题目内容
13.请根据反应 Fe+CuSO4=Fe SO4+Cu,设计原电池,完成以下问题.负极:Fe,其电极反应式为:Fe-2e-=Fe2+
正极:Cu,其电极反应式为:Cu2++2e-=Cu
电解质溶液:CuSO4,电池的总离子反应式为:Fe+Cu2+=Fe2++Cu.
分析 该原电池中,Fe元素化合价由0价变为+2价、Cu元素化合价由+2价变为0价,所以Fe作负极、不如铁活泼的金属或导电的非金属作正极,负极上Fe失电子生成亚铁离子,正极上铜离子得电子发生还原反应生成Cu,发生氧化反应的电解质溶液为该原电池电解质溶液,据此分析解答.
解答 解:该原电池中,Fe元素化合价由0价变为+2价、Cu元素化合价由+2价变为0价,所以Fe作负极、不如铁活泼的金属或导电的非金属作正极,如Cu作正极,负极上Fe失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+;
正极上铜离子得电子发生还原反应生成Cu,电极反应式为Cu2++2e-=Cu;
发生氧化反应的电解质溶液为该原电池电解质溶液,硫酸铜发生氧化反应,所以电解质溶液为CuSO4溶液,电池反应离子方程式为Fe+Cu2+=Fe2++Cu,
故答案为:Fe;Fe-2e-=Fe2+;Cu;Cu2++2e-=Cu;CuSO4;Fe+Cu2+=Fe2++Cu.
点评 本题考查原电池设计,明确原电池原理是解本题关键,难点是判断正负极及电解质溶液,一般来说,失电子的金属作负极、发生氧化反应的电解质溶液为该原电池电解质溶液.

练习册系列答案
相关题目
3.下列化合物中不能由单质直接化合而成的是( )
| A. | Fe3O4 | B. | HF | C. | FeCl2 | D. | CuCl2 |
8.下列电子式表示正确的是( )
| A. | Cl2: | B. | NaCl: | C. | NaOH: | D. | H2O: |
18.以下反应属于吸热反应的是( )
| A. | 生石灰加水制熟石灰 | B. | 化石燃料的燃烧 | ||
| C. | 氢氧化钠溶液中滴加稀盐酸 | D. | 二氧化碳与高温的炭 |
5.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增多而增多 | |
| B. | 单质的颜色随核电荷数的增多而加深 | |
| C. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增多而增强 |
3.能通过化学反应使溴水褪色,又能使高锰酸钾溶液褪色的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙烷 | D. | 乙烯 |