题目内容
7.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.提高氧气的浓度 C.降低反应的温度 D.提高反应的温度
(2)从断键和成键的角度分析上述反应中能量的变化.
已知键能:H-H436kJ•mol-1O=O 496kJ•mol-1H-O 463kJ•mol-1在理论上1mol O2充分反应生成水放出热量(填吸收或放出)484kJ.
(3)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒,其中氢气(填“正”或“负”)负极发生氧化反应(填“氧化”或“还原”),电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
分析 (1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
(2)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和;
(3)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,以此解答.
解答 解:(1)A.使用催化剂,加快反应速率,故A不选;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B不选
C. 适当降低反应的温度,反应速率减慢,故D不选;
D.适当提高反应的温度,反应速率加快,故C不选;
故答案为:C;
(2)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol 1mol O2充分反应生成水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即1mol O2充分反应生成水的热量为484kJ,
故答案为:放出;484;
(3)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,则电路中每转移0.2mol电子,标准状况下消耗H2的体积是0.1mol×22.4L/mol=2.24L,故答案为:负;氧化;2.24.
点评 本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池等,为高频考点,侧重化学反应原理的考查,有利于基础知识的夯实,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
7.下列说法正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| C. | 明矾既可以用于净水,又可杀菌消毒 | |
| D. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H不变 |
18.下列说法正确,且能用原电池原理解释的是( )


| A. | 合金一定比纯金属耐腐蚀 | |
| B. | 如图,在铁棒上产生气泡,碳棒上没有气泡 | |
| C. | 在锌与稀硫酸反应时,加入硫酸铜溶液可以加快反应速率 | |
| D. | 铝不需要特别处理就具有抗腐蚀能力 |
2.下列有关该实验的说法中正确的是( )
| A. | 除去硝基苯中混有的少量浓HNO3和H2SO4,可将其倒入到一定量的NaOH溶液中,振荡后静置分液 | |
| B. | 乙酸与丙烯酸属于同系物 | |
| C. | 聚丙烯酸能够使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙烷中的乙烯,可通过酸性高锰酸钾溶液或溴水 |
12.有下列四组物质,每组内物质互为同分异构体的是( )
| A. | 12C和14C | B. | O2与O3 | ||
| C. | 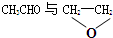 | D. | CH3CH2CH2CH3与CH3CH2CH2CH2CH3 |
16.有效氯含量是含氯消毒剂的一个重要指标,其定义为:从HI中氧化出相同量的I2所需Cl2质量与指定含氯消毒剂的质量比.则ClO2的有效氯含量为( )
| A. | 0.263 | B. | 2.63 | C. | 0.132 | D. | 1.32 |
17.核磁共振氢谱是测定有机物分子结构最有用的工具之一?在有机物分子中,不同的氢原子在质子核磁共振谱中给出的峰值(信号)不同,根据峰(信号)可以确定有机物分子中氢原子的种类?下列有机物分子中,在质子核磁共振谱中只给出一种峰(信号)的是( )
| A. | CH3OH | B. | CH3OCOOCH3 | C. | CH3CH2C(CH3)3 | D. | CH3COOH |
 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.

