题目内容
19.已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
CaCO3(s)=CaO(s)=CO2(g)△H=178.2kJ•mol-1
若要将1t碳酸钙煅烧成生石灰,理论上至少需要多少千克焦炭?
分析 碳酸钙生成生石灰需要吸收热量,碳燃烧过程是放热反应,1t石灰石分解需要的热量由碳燃烧放出的热量提供,依据热化学方程式计算得到.
解答 解:1t 碳酸钙生成生石灰,依据热化学方程式计算可知吸收热量为:1×106g×$\frac{178.2kJ}{100g}$=1.782×106kJ;
设理论上需焦炭x千克
C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
12g 393.5kJ
x×1000 1.782×106kJ
x=$\frac{12g×1.782×1{0}^{6}kJ}{393.5kJ×1000}$≈54.34kg,
答:1t 碳酸钙生成生石灰理论上需含焦炭54.34千克.
点评 本题考查了热化学方程式的计算应用,注意碳酸钙分解需要的热量等于碳燃烧放出的热量,热化学方程式的计算是解题关键,题目难度中等.

练习册系列答案
相关题目
9.实验室用二氧化锰和浓盐酸制取氯气时,最佳的除杂试剂和方法是( )
| A. | 水、浓H2SO4、洗气 | B. | 饱和NaHCO3溶液、浓H2SO4、洗气 | ||
| C. | 饱和NaCl溶液、浓H2SO4、洗气 | D. | NaOH溶液、浓H2SO4、洗气 |
7.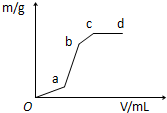 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )| A. | ab段产生的沉淀为硫酸钡 | |
| B. | ab产生段的沉淀为氢氧化镁 | |
| C. | bc段产生的沉淀为氢氧化镁 | |
| D. | bc段产生的沉淀为硫酸钡和氢氧化镁 |
4.向27.2gCu和Cu20的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(N03)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性.金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
| A. | Cu与Cu20的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.4mol/L | |
| C. | 产生的NO在标准状况下的体枳为4.48L | |
| D. | Cu、Cu20与硝酸反应后剩余HN03为lmol |
6.某研究小组利用硫铁矿烧渣(主要成分是Fe2O3,还有少量的FeO、Fe3O4、Al2O3、SiO2等杂质)制备FeSO4•7H2O晶体的流程如图:
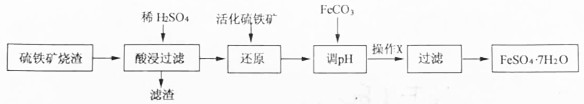
已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
请回答下列问题:(1)酸浸时主要反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,滤渣的主要成分是SiO2
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.

已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.
7.下列溶液一定呈中性的是( )
| A. | c(H+)=1×10-7 mol/L | B. | c(OH-)=1×10-7mol/L | ||
| C. | c(H+)=c(OH-) | D. | pH=7 |
 在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:
在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题: