题目内容
关于下列装置说法正确的是( )


| A、装置①中,盐桥中的K+移向CuSO4溶液 |
| B、装置①中,Zn为负极,发生还原反应 |
| C、装置②中的Fe发生析氢腐蚀 |
| D、装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:装置①为原电池,锌被铜活泼,锌为负极,铜为正极,原电池工作时阳离子向正极移动,阴离子向负极移动,装置②为铁的吸氧腐蚀,铁被氧化,为负极,石墨为正极,氧气在正极得到电子,以此解答该题.
解答:
解:A.装置①为原电池,锌被铜活泼,锌为负极,铜为正极,盐桥中的K+移向CuSO4溶液,即向正极移动,故A正确;
B.装置①中,Zn为负极,发生氧化反应,故B错误;
C.装置②电解质为氯化钠,溶液呈中性,铁发生吸氧腐蚀,故C错误;
D.电子只能经过外电路,不能经过溶液,故D错误.
故选A.
B.装置①中,Zn为负极,发生氧化反应,故B错误;
C.装置②电解质为氯化钠,溶液呈中性,铁发生吸氧腐蚀,故C错误;
D.电子只能经过外电路,不能经过溶液,故D错误.
故选A.
点评:本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极的判断和电极方程式的书写,为解答该类题目的关键,难度不大,注意把握原电池的工作原理.

练习册系列答案
相关题目
下列解释实验现象的反应方程式正确的是( )
| A、向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色Cu(OH)2(s)+S2-?CuS(s)+2OH- |
| B、在H2O2溶液中,滴加FeC13溶液产生气泡:2H2O2+2C1-=2H2O+O2↑+C12↑ |
| C、将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生:Cu+2H+=Cu2++H2↑ |
| D、在CH3COONa溶液中,滴加酚酞变红:CH3COO-+H2O=CH3COOH+OH- |
下列离子方程式书写正确的是( )
| A、铁与稀硫酸反应:Fe+2H+=Fe3++H2↑ |
| B、钠与冷水反应:Na+2H2O=Na++2OH-+H2↑ |
| C、醋酸与大理石反应:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O |
D、二氧化碳与苯酚钠溶液反应: +H2O+CO2→ +H2O+CO2→ +HCO3- +HCO3- |
下列事实可证明一水合氨是弱电解质的是( )
| A、0.1mol/L的氨水可使酚酞试液变红 |
| B、0.1mol/L的氯化铵溶液的pH约为5 |
| C、在相同条件下,氨水溶液的导电性比强碱溶液弱 |
| D、铵盐受热易分解 |
把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液以等体积混和后溶液显酸性,则混合液中微粒浓度关系正确的为( )
| A、c(CH3COO-)<c(Na+) |
| B、c(CH3COOH)+c(CH3COO-)=0.02mol/L |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(OH-)+c(CH3COO-)═c(H+)+c(Na+) |
下列不属于水解反应方程式的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、MgCl2+2H2O?Mg(OH)2+2HCl |
| C、HCO3-+H2O?CO32-+H3O+ |
| D、ClO-+H2O?HClO+OH- |
某国外化学教材中有一张关于氧化还原反应的插图:由图可知, 在该反应中是( )
在该反应中是( )
 在该反应中是( )
在该反应中是( )
| A、还原剂 | B、氧化剂 |
| C、氧化产物 | D、还原产物 |

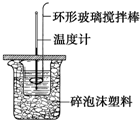 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下: