题目内容
17.乙酸橙花酯是一种食用香精,结构如图所示.下列关于该物质的说法不正确的是( )
| A. | 分子式为C11H18O2 | |
| B. | 该化合物含有两种官能团 | |
| C. | 该化合物能在碱性溶液中发生取代反应 | |
| D. | 该化合物能使酸性KMnO4溶液褪色,发生氧化反应 |
分析 由有机物的结构简式可知,分子中含碳碳双键、-COOC-,结合烯烃和酯的性质来解答.
解答 解:A.由结构简式可知,分子式C12H20O2,故A错误;
B.有机物含有酯基和碳碳双键两种官能团,故B正确;
C.含有酯基,可在碱性条件下发生水解反应,也为取代反应,故C正确;
D.含有碳碳双键,可与高锰酸钾发生氧化还原反应,故D正确.
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重于学生的分析能力的考查,把握常见有机物的官能团为解答的关键,熟悉烯烃、酯的性质即可解答,题目难度不大.

练习册系列答案
相关题目
5.在一定温度下,盛有催化剂的体积一定的密闭容器中,通入一定量的SO3气体,发生分解反应2SO3?2SO2+O2,并达到平衡状态,测得SO3的分解率为75%.下列说法正确的是( )
| A. | 平衡后的压强为起始压强的1.25倍 | |
| B. | 平衡时混合气体的平均相对分子质量为64 | |
| C. | 混合气体的密度自始至终保持不变 | |
| D. | 取和SO3等质量的SO2和O2的混合气体,从逆反应开始并达到平衡,在相同条件下各物质的浓度与原来的平衡浓度一定相等 |
12. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).( )| 选项 | a中物质 | b中物质 | c中收集气体 | d中物质 | |
| A | 浓氨水 | CaO | NH3 | H2O | |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 | |
| C | 浓硝酸 | Cu | NO2 | H2O | |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 | |
| A. | A | B. | B | C. | C | D. | D |
2.下列有关化学键和化合物的叙述正确的有几个( )
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤非金属原子间不可能形成离子键
⑥稀有气体中不存在共价键.
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤非金属原子间不可能形成离子键
⑥稀有气体中不存在共价键.
| A. | 2 个 | B. | 3个 | C. | 4个 | D. | 5个 |
9.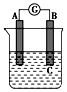 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Cu,B是Fe,C为稀Cu(NO3)2溶液 | D. | A是Fe,B是Ag,C为稀AgNO3溶液 |
7.某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案:
(1)请写出实验步骤、预期现象,对应的离子方程式.
(限选试剂:铁粉、3mol/L H2SO4、0.1mol/L酸性KMnO4溶液、10% H2O2、KSCN溶液)
④操作步骤③中反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验.
已知:气体由草酸晶体受热分解得到:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+CO↑+3H2O.
且除铁红外所用试剂均过量.

①装置A、B中的试剂依次是氢氧化钠溶液、浓硫酸.
②气体通入后,接下来的操作是用点燃的小木条靠近肥皂泡,直到肥皂泡安静燃烧,然后对C装置加热.
③实验前后称得D装置增重8.8g,则此铁红中铁的质最分数是72.41%.
(1)请写出实验步骤、预期现象,对应的离子方程式.
(限选试剂:铁粉、3mol/L H2SO4、0.1mol/L酸性KMnO4溶液、10% H2O2、KSCN溶液)
| 操作步骤 | 预期现象 |
| ①取少量样品于试管中,加入足量的3mol/LH2SO4,充分振荡,将所得澄清的溶液分装在两支试管中. | |
| ②向一支试管中加入足量铁粉,充分振荡;再加入足量3mol/LH2SO4,充分振荡. | 若出现红色固体,则含有CuO. |
| ③向另一支试管中加入0.01mol/L酸性KMnO4溶液. | 若溶液紫红色褪去则含有FeO. |
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验.
已知:气体由草酸晶体受热分解得到:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+CO↑+3H2O.
且除铁红外所用试剂均过量.

①装置A、B中的试剂依次是氢氧化钠溶液、浓硫酸.
②气体通入后,接下来的操作是用点燃的小木条靠近肥皂泡,直到肥皂泡安静燃烧,然后对C装置加热.
③实验前后称得D装置增重8.8g,则此铁红中铁的质最分数是72.41%.
8.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 1molFeBr2与足量的氯气反应时转移的电子数为2NA | |
| D. | 25℃时pH=11的Na2CO3溶液中水电离出的OH-的数目为0.001NA |
 +Br2$→_{CCl_{4}}^{Fe粉}$
+Br2$→_{CCl_{4}}^{Fe粉}$ +HBr
+HBr +2H2O.
+2H2O.
