题目内容
12.淀粉和蛋白质都是重要的营养物质,它们都能发生水解反应.(1)蛋白质水解的最终产物是(填名称)氨基酸.
(2)为证明淀粉在酸性条件已经开始水解,可在水解液中依次加入NaOH溶液与新制的氢氧化铜或银氨溶液并加热进行检验,现象是有砖红色沉淀或银白色固体生成.
分析 (1)蛋白质是由氨基酸形成的;
(2)淀粉水解生成葡萄糖,葡萄糖含有醛基,能与新制的氢氧化铜或银氨溶液反应生成砖红色氧化亚铜或银镜.
解答 解:(1)蛋白质水解最终生成氨基酸,故答案为:氨基酸;
(2)淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,新制的氢氧化铜或银氨溶液,若有砖红色沉淀或银白色固体生成,则淀粉已经开始水解,故答案为:NaOH;新制的氢氧化铜或银氨溶液;有砖红色沉淀或银白色固体生成;
点评 本题考查糖类、氨基酸、蛋白质的结构和性质特点,题目难度不大,注意醛基的检验方法.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
2.28g铜、银合金与一定量某浓度的硝酸溶液反应,金属完全溶解,放出的气体与2.24L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是( )
| A. | 3.2g | B. | 6.4g | C. | 12.8g | D. | 21.6g |
3.下列物质一般情况下不能与NaOH溶液反应的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | NaHCO3 |
20.下列有关化学用语正确的是( )
| A. | 聚丙烯的结构简式: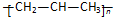 | B. | 二氧化碳的电子式: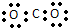 | ||
| C. | 乙酸的分子式:CH3COOH | D. | 中子数为18的硫原子:3416S |
7.元素周期律揭示了元素间的递变规律,下列说法正确的是( )
| A. | VIIA族元素的非金属性:F>Cl,所以VIIA族元素氢化物的酸性:HF>HCl | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,所以第三周期元素氢化物稳定性:HCl>H2S | |
| C. | 第二周期主族元素最外层电子数从1递增至7,所以第二周期主族元素的最高化合价也从+1递增至+7 | |
| D. | 工业制取金属钾的反应为:KCl (1)+Na (1)$\frac{\underline{\;850℃\;}}{\;}$NaCl(1)+K(g),所以金属性:Na>K |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、CO32-、NO3- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
4.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L 1 mol•L-1的Fe2(SO4)3 溶液加热蒸干得到Fe(OH)3胶体粒子的数目为2NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64 g |
11.在H2与Cl2生成HCl的反应中,已知断裂1molH-H 键吸收的能量为akJ,断裂1molCl-Cl键吸收的能量为bkJ,形成1molH-Cl键放出的能量为ckJ,则生成1mol HCl放出的能量为( )
| A. | (c-a-b)kJ | B. | (a+b-c)kJ | C. | (2c-a-b)kJ | D. | (2c-a-b)/2 kJ |