题目内容
下列表达式错误的是( )
A、甲烷的电子式: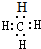 |
B、氮原子的L层电子的电子排布图 |
| C、硫离子的核外电子排布式1s22s22p63s23p4 |
| D、根据价电子对互斥理论,H3O+的空间构型为三角锥形 |
考点:电子式,原子核外电子排布,判断简单分子或离子的构型
专题:原子组成与结构专题,化学键与晶体结构
分析:A.甲烷中存在4对共用电子对;
B.氮原子的L层电子有5个电子,2p电子优先单独占据1个轨道;
C.硫离子的核外电子数为18;
D.O原子的价层对子对数为3+
(6-1-3×1)=4,VSEPR模型为四面体,含有一个孤电子对,因此空间构型为三角锥形.
B.氮原子的L层电子有5个电子,2p电子优先单独占据1个轨道;
C.硫离子的核外电子数为18;
D.O原子的价层对子对数为3+
| 1 |
| 2 |
解答:
解:A.甲烷中存在4对共用电子对,则甲烷的电子式为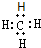 ,故A正确;
,故A正确;
B.氮原子的L层电子有5个电子,2p电子优先单独占据1个轨道,则氮原子的L层电子的电子排布图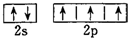 ,故B正确;
,故B正确;
C.硫离子的核外电子数为18,其硫离子的核外电子排布式1s22s22p63s23p6,故C错误;
D.O原子的价层对子对数为3+
(6-1-3×1)=4,VSEPR模型为四面体,含有一个孤电子对,因此空间构型为三角锥形,故D正确;
故选C.
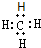 ,故A正确;
,故A正确;B.氮原子的L层电子有5个电子,2p电子优先单独占据1个轨道,则氮原子的L层电子的电子排布图
 ,故B正确;
,故B正确;C.硫离子的核外电子数为18,其硫离子的核外电子排布式1s22s22p63s23p6,故C错误;
D.O原子的价层对子对数为3+
| 1 |
| 2 |
故选C.
点评:本题考查化学用语、价层电子对互斥理论,为高频考点,试题基础性强,涉及电子式、电子排布图、电子排布式及原子构成等,把握电子排布规律及化学用语的规范应用为解答的关键,题目难度不大.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
某物质含有极性共价键,则下列说法不正确的是( )
| A、可能含有离子键 |
| B、可能是无机物或有机物 |
| C、可能是单质或化合物 |
| D、不可能是金属晶体 |
下列关于物质“反应程度”的说法正确的是( )
| A、一定条件下,2mol SO2与足量O2反应可得到2mol SO3 |
| B、含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C、10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 |
| D、一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
如图是CH4、CCl4、CH3Cl的分子球棍模型图.下列说法正确的是( )
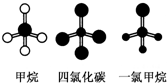

| A、CH4、CCl4和CH3Cl都是正四面体结构 |
| B、CH4、CCl4都是正四面体结构 |
| C、CH4和CCl4中的化学键完全相同 |
| D、CH4、CCl4的结构相同,性质也相同 |
若阿伏伽德罗常数的数值用NA表示,下列说法正确的是( )
| A、标准状况下,1.12L氦气所含原子数为0.1NA |
| B、1.6gNH2-离子所含质子数为NA |
| C、22.4LHCI溶于水,溶液中H数为NA |
| D、9gD2O所含的中子数为4.5NA |
下列化学式代表的物质一定有固定沸点的是( )
| A、C3H6 |
| B、C2H4O2 |
| C、CF2Cl2 |
| D、C3H7OH |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、CH2=CH2+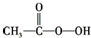 (过氧乙酸)→ (过氧乙酸)→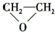 +CH3COOH +CH3COOH | ||
B、CH2=CH2+Cl2+Ca(OH)2→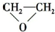 +CaCl2+H2O +CaCl2+H2O | ||
C、2CH2=CH2+O2
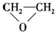 | ||
D、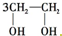
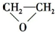 +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |