题目内容
若阿伏伽德罗常数的数值用NA表示,下列说法正确的是( )
| A、标准状况下,1.12L氦气所含原子数为0.1NA |
| B、1.6gNH2-离子所含质子数为NA |
| C、22.4LHCI溶于水,溶液中H数为NA |
| D、9gD2O所含的中子数为4.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.稀有气体为单原子分子,根据n=
计算出氦气的物质的量及含有的原子数;
B.NH2-离子的摩尔质量为16g/mol,NH2-离子中含有9个质子;
C.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氯化氢的物质的量;
D.重水中含有10个中子,重水的摩尔质量为20g/mol,9g重水的物质的量为0.45mol,含有4.5mol中子.
| V |
| 22.4L/mol |
B.NH2-离子的摩尔质量为16g/mol,NH2-离子中含有9个质子;
C.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氯化氢的物质的量;
D.重水中含有10个中子,重水的摩尔质量为20g/mol,9g重水的物质的量为0.45mol,含有4.5mol中子.
解答:
解:A.标况下1.12L氦气的物质的量为0.05mol,0.05mol氦气中含有0.05mol氦原子,所含原子数为0.05NA,故A错误;
B.NH2-离子中含有质子数为9,1.6g该离子的物质的量为0.1mol,含有0.9mol质子,所含质子数为0.9NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算22.4L氯化氢的物质的量,故C错误;
D.9g重水的物质的量为0.45mol,0.45mol重水中含有4.5mol中子,所含的中子数为4.5NA,故D正确;
故选D.
B.NH2-离子中含有质子数为9,1.6g该离子的物质的量为0.1mol,含有0.9mol质子,所含质子数为0.9NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算22.4L氯化氢的物质的量,故C错误;
D.9g重水的物质的量为0.45mol,0.45mol重水中含有4.5mol中子,所含的中子数为4.5NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项A为易错点,注意稀有气体为单原子分子.

练习册系列答案
相关题目
下列说法正确的是( )
| A、煤等化石燃料是可再生能源,提高物质的燃烧效率对于节约能源十分重要 |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、强电解质溶液的导电能力一定强 |
| D、化合物不是电解质就是非电解质 |
下列化学用语表达正确的是( )
| A、碳酸钠的水解方程式:2H2O+CO32-?H2CO3+2OH- |
| B、碳酸的电离方程式:H2CO3?2H++CO32- |
| C、氯化铁发生水解的离子方程式:Fe3++3H2O?Fe (OH)3+3H+ |
| D、碳酸氢钠在水溶液中的电离:NaHCO3?Na++HCO3- |
下列各组物质中,分子数相同的是( )
| A、2 LSO2和2 LCO2 |
| B、9 g水和标准状况下 11.2 LCO2 |
| C、标准状况下1 mol氧气和 22.4 L水 |
| D、0.1 mol氢气和 2.24 L氯化氢气体 |
下列表达式错误的是( )
A、甲烷的电子式: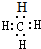 |
B、氮原子的L层电子的电子排布图 |
| C、硫离子的核外电子排布式1s22s22p63s23p4 |
| D、根据价电子对互斥理论,H3O+的空间构型为三角锥形 |
NaOH、Na2CO3、NaCl可按某种标准划为一类物质,下列分类标准不正确的是( )
| A、钠的化合物 | B、可与盐酸反应 |
| C、可溶于水 | D、电解质 |
下列说法正确的是( )
| A、羟基与氢氧根有相同的化学式和电子式 |
| B、乙醇的官能团是-OH,乙醇是含-OH的化合物 |
| C、常温下,1mol乙醇可与足量的Na反应生成11.2L H2 |
D、 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为②③ |
将苯与溴水混合,充分振荡后静置,用分液漏斗分离出上层液体放置于一试管中,若向其中加入一种试剂,可发生反应并产生白雾,这种试剂可以是( )
| A、亚硫酸钠 | B、溴化铁 |
| C、锌粉 | D、铁粉 |