题目内容
20.下列说法正确的是( )| A. | 体积相等pH=12的氨水和NaOH溶液中和盐酸的能力相同 | |
| B. | 室温下,向NH4HSO4溶液中加入NaOH溶液至中性,则c(SO42-)>c(Na+)>c(NH4+) | |
| C. | 物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中:2c(CH3COO-)+2c(CH3COOH)=3c(Na+) | |
| D. | 向10ml 0.01mol/L AgNO3溶液中依次滴入2~3滴0.01mol/L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Kap(AgI)<Kap(AgCl) |
分析 A.氨水为弱碱,氨水的浓度大于氢氧化钠溶液;
B.溶液呈中性,NH4HSO4、NaOH的物质的量大于1:1,小于2:1,则溶液中存在硫酸钠、硫酸铵以及一水合氨,混合溶液呈中性,则c(H+)=c(OH-),结合物料守恒判断;
C.根据混合液中的物料守恒判断;
D.硝酸银过量,不能比较溶度积大小.
解答 解:A.氨水为弱碱,pH=12的氨水的浓度大于NaOH溶液,则等体积的两溶液中和盐酸的能力:氨水>NaOH溶液,故A错误;
B.A.溶液呈中性,NH4HSO4、NaOH的物质的量大于1:1,小于2:1,则溶液中存在硫酸钠、硫酸铵以及一水合氨,混合溶液呈中性,则c(H+)=c(OH-),结合物料守恒知c(Na+)>c(SO42-),铵根离子水解,所以存在c(SO42-)>c(NH4+),则溶液中离子浓度大小顺序是:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),故B错误;
C.物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中,根据物料守恒可得:2c(CH3COO-)+2c(CH3COOH)=3c(Na+),故C正确;
D.硝酸银过量,不能比较溶度积大小,应在氯化银饱和溶液中加入NaI证明,故D错误;
故选C.
点评 本题考查较为综合,涉及离子浓度大小比较、酸碱混合的定性判断、难溶物溶解平衡及沉淀转化等知识,明确弱电解质的电离特点为解答关键,注意掌握电荷守恒、物料守恒及盐的水解在判断离子浓度大小中的应用方法,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.化学与社会、生活密切相关.下列叙述正确的是( )
| A. | 硅是光导纤维的主要成分 | |
| B. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| C. | 碳纤维是一种新型有机高分子材料 | |
| D. | 硅胶可做药品和食品的干燥剂 |
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L 1mo/L的FeCl3溶液中含有的Fe3+为1NA | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1mol铜与足量硫反应,转移的电子总数为NA | |
| D. | 18g D2O(重水)中所含电子个数为10 NA |
5.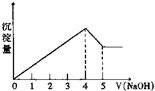 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )| A. | 2:1 | B. | 4:1 | C. | 1:2 | D. | 1:1 |
12.下列离子方程式中,正确的是( )
| A. | 向盐酸中加入几滴碳酸钠溶液:H++CO32-═HCO3- | |
| B. | 向三氯化铁溶液中加入碘化钾溶液:Fe3++2I-═Fe2++I2 | |
| C. | 过量的铁粉加入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 等物质的量浓度的明矾溶液与氢氧化钡溶液按体积比1:2混合:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
9.下列实验操作正确的是( )
| A. |  检查容量瓶是否漏水 | B. |  给液体加热 | ||
| C. |  称量 | D. |  过滤 |
10.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA | |
| B. | 0.1 mol NH2-中含有的电子数为0.9NA | |
| C. | 3.4 g H2O2中含有的共用电子对数为0.1NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
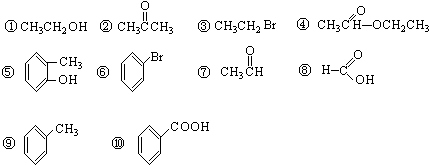
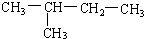 (8)
(8)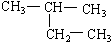 (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)