题目内容
火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2=Cu2S+FeS+SO2则下列说法正确的是( )
| A、CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 |
| B、每生成1mol SO2转移6mol电子 |
| C、SO2既是氧化产物又是还原产物,FeS只是还原产物 |
| D、每转移1.2 mol电子,有0.3 mol氧气被还原 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,以此解答该题.
解答:
解:A.Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,CuFeS2既是氧化剂又是还原剂,硫元素只被氧化,故A错误;
B.元素化合价升高的只有S元素,由-2价升高到+4价,变化6价,则每生成1mol SO2转移6mol电子,故B正确;
C.生成FeS,元素化合价没有变化,FeS不是还原产物,也不是氧化产物,故C错误;
D.由方程式可知,每转移6mol电子,由1mol氧气被还原,则每转移1.2 mol电子,有0.2 mol氧气被还原,故D错误;
故选B.
B.元素化合价升高的只有S元素,由-2价升高到+4价,变化6价,则每生成1mol SO2转移6mol电子,故B正确;
C.生成FeS,元素化合价没有变化,FeS不是还原产物,也不是氧化产物,故C错误;
D.由方程式可知,每转移6mol电子,由1mol氧气被还原,则每转移1.2 mol电子,有0.2 mol氧气被还原,故D错误;
故选B.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.

练习册系列答案
相关题目
蓄电池在放电时起原电池作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
| 放电 |
| 充电 |
| A、放电时正极附近pH增大 |
| B、充电时阴极的电极反应式为:Fe(OH)2+2e-═Fe+2OH- |
| C、放电时电解质溶液中的阴离子向正极方向移动 |
| D、蓄电池的电极可浸入某种碱性电解质溶液中 |
1mol乙烯与氯化氢在一定条件下完全加成后,再与氯气在一定条件下发生取代,整个过程最多需要氯气为( )
| A、1mol | B、4mol |
| C、5mol | D、6mol |
下列各项化学语言表达正确的是( )
A、F的原子结构示意图: | ||
B、NH4Br的电子式: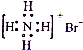 | ||
C、原子核内有l8个中子的氯原子:
| ||
| D、乙烯的结构简式:CH2CH2 |
下列各组物质,互为同分异构体的是( )
A、
| ||||
| B、O2和O3 | ||||
C、 和 和 | ||||
D、 与 与 |
提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | CCl4 | 萃取、分液 |
| B | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A、A | B、B | C、C | D、D |
对处于平衡状态的反应:2A(g)+B(g)?2C(g)△H<0,下列叙述正确的是( )
| A、增大压强,v(正)增大,v(逆)减小 |
| B、升高温度,v(正)减小,v(逆)增大 |
| C、增大A浓度的瞬间,v(正)增大,v(逆)不变 |
| D、增大A浓度的瞬间,v(正)增大而v(逆)减小 |
下列说法中错误的是( )
| A、在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 |
| B、离子键、共价键、氢键都是化学键 |
| C、元素周期律是元素原子核外电子排布周期性变化的必然结果 |
| D、卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 |