题目内容
如图是配制一定物质的量浓度溶液的过程示意图.下列说法中错误的是( )
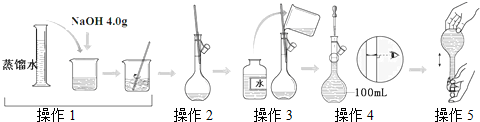

| A、所配制的NaOH溶液物质的量浓度为1.0 mol/L |
| B、操作2是将NaOH加水溶解后直接转移到容量瓶中 |
| C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D、操作5中,定容摇匀后发现液面低于刻度线,不能再继续加水 |
考点:配制一定物质的量浓度的溶液
专题:
分析:A、由图可知,所配溶液的体积为100mL,根据n=
计算碳酸钠的物质的量,再根据c=
计算所配溶液的浓度;
B、氢氧化钠溶于水放热;
C、操作4是定容,应滴加水至溶液凹液面的最低点与刻度线平齐;
D、定容摇匀后发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至液面与刻度线平齐,导致所配溶液的体积偏大.
| m |
| M |
| n |
| V |
B、氢氧化钠溶于水放热;
C、操作4是定容,应滴加水至溶液凹液面的最低点与刻度线平齐;
D、定容摇匀后发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至液面与刻度线平齐,导致所配溶液的体积偏大.
解答:
解:A、由图可知,所配溶液的体积为100mL,4g氢氧化钠的物质的量为
=0.1mol,所配碳酸钠溶液的浓度为
=1mol/L,故A正确;
B、氢氧化钠溶于水放热,应先冷却,故B错误;
C、操作4是定容,应滴加水至溶液凹液面的最低点与刻度线平齐,故C正确;
D、定容摇匀后发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至液面与刻度线平齐,导致所配溶液的体积偏大,所配溶液的浓度偏小,故D正确.
故选B.
| 4g |
| 40g/mol |
| 0.1mol |
| 0.1L |
B、氢氧化钠溶于水放热,应先冷却,故B错误;
C、操作4是定容,应滴加水至溶液凹液面的最低点与刻度线平齐,故C正确;
D、定容摇匀后发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至液面与刻度线平齐,导致所配溶液的体积偏大,所配溶液的浓度偏小,故D正确.
故选B.
点评:本题考查一定物质的量浓度溶液的配制,难度不大,注意根据c=
理解溶液的配制.
| n |
| V |

练习册系列答案
相关题目
某溶液中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等,现将该溶液分成4份,分别进行如下实验则下列说法不正确的是( )
①酸化后滴加适量的淀粉KI溶液,呈蓝色;
②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
①酸化后滴加适量的淀粉KI溶液,呈蓝色;
②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
| A、该溶液中一定含有NO3-、SO42-、NH4+ |
| B、根据实验④可推出溶液中不存在NO2-与SO32- |
| C、往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl- |
| D、根据实验①可推出溶液中含有NO3-或NO2- |
下列叙述正确的是( )
| A、浓度均为0.1mol?L-1的小苏打溶液与烧碱溶液等体积混合c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| B、某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mLpH=12的Ba(OH)2溶液与40mLcmol?-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |
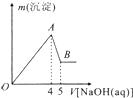 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |
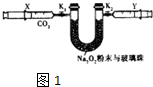 (1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
(1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是