题目内容
将36.5g HCl溶解于1L水中(水的密度近似为1g/mL)所得溶液的密度为ρ g/mL,质量分数为ω,物质浓度为c mol/L,用NA表示阿伏伽德罗常数,下列关系中正确的是( )
| A、所得溶液的物质的量浓度:c=1mol/L | ||
B、所得溶液中Cl-的浓度为
| ||
| C、36.5g HCl气体的体积为22.4L | ||
| D、溶液的质量分数3.65% |
考点:物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:
分析:A.n(HCl)=
=1mol,溶液的质量=(36.5+1000)g=1036.5g,溶液的体积=
×10-3 L/mL,根据c=
计算其物质的量浓度;
B.根据Cl原子守恒得n(Cl- )=n(HCl),再根据c=
计算Cl-物质的量浓度;
C.气体摩尔体积受温度和压强影响,温度、压强不同气体摩尔体积不同;
D.溶液的质量分数=
×100%.
| 36.5g |
| 36.5g/mol |
| 1036.5g |
| ρg/mL |
| n |
| V |
B.根据Cl原子守恒得n(Cl- )=n(HCl),再根据c=
| n |
| V |
C.气体摩尔体积受温度和压强影响,温度、压强不同气体摩尔体积不同;
D.溶液的质量分数=
| 溶质的质量 |
| 溶液的质量 |
解答:
解:A.n(HCl)=
=1mol,溶液的质量=(36.5+1000)g=1036.5g,溶液的体积=
×10-3 L/mL,溶液的物质的量浓度c=
=
=
mol/L,故A错误;
B.根据Cl原子守恒得n(Cl- )=n(HCl),氯离子的物质的量浓度c=
=
=
mol/L,故B正确;
C.气体摩尔体积受温度和压强影响,温度、压强不同气体摩尔体积不同,温度、压强未知,则无法计算气体体积,故C错误;
D.溶液的质量分数=
×100%=
×100%=3.5%,故D错误;
故选B.
| 36.5g |
| 36.5g/mol |
| 1036.5g |
| ρg/mL |
| n |
| V |
| 1mol | ||
(
|
| 1000ρ |
| 1000+36.5 |
B.根据Cl原子守恒得n(Cl- )=n(HCl),氯离子的物质的量浓度c=
| n |
| V |
| 1mol | ||
(
|
| 1000ρ |
| 1000+36.5 |
C.气体摩尔体积受温度和压强影响,温度、压强不同气体摩尔体积不同,温度、压强未知,则无法计算气体体积,故C错误;
D.溶液的质量分数=
| 溶质的质量 |
| 溶液的质量 |
| 36.5g |
| 1036.5g |
故选B.
点评:本题考查物质的量浓度、质量分数、气体体积的计算,侧重考查学生分析、计算能力,知道各个物理量之间的关系是解本题关键,熟记基本公式,易错选项是C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图是分离乙酸乙醋、乙酸和乙醇混合物的实验操作流程图:
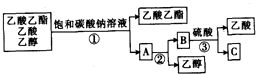
上述实验过程中所涉及的三次分离操作依次是( )

上述实验过程中所涉及的三次分离操作依次是( )
| A、①蒸馏 ②过滤 ③分液 |
| B、①分液 ②蒸馏 ③蒸馏 |
| C、①蒸馏 ②分液 ③分液 |
| D、①分液 ②蒸馏 ③结晶、过滤 |
2013年12月2日嫦娥三号月球探测器在西昌卫星发射中心成功,探测器使用被称为“软电池”的可充电电池.电池总反应的化学方程式为:Zn+2MnO2+H2O
Zn(OH)2+Mn2O3,下列说法错误的是( )
| 软电 |
| 充电 |
| A、电池工作时,正极电极反应式为:2MnO2+H2O+2e-=Mn2O3+2OH- |
| B、电池充电时,与电源负极相连的电极反应为:Zn(OH)2+2e-=Zn+2OH- |
| C、电池工作时,电子由正极通过外电路流向负极 |
| D、电池工作时,外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、非金属性最强的元素为W |
| C、Y的最高价氧化物对应的水化物不是强碱 |
| D、XW2分子中各原子最外层电子均达到电子结构 |
当航天飞机返回地球进入大气层时,由于空气的剧烈摩擦,航天飞机尖端的温度超过1000℃.为防止高温将其烧毁,科学家给航天飞机相应部位设计安装了可靠的保护层.制作保护层的材料可能为( )
| A、合成塑料 | B、新型陶瓷 |
| C、镁铝合金 | D、不锈钢 |
将15.6gNa2O2和5.4gAl时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准况下的HCl气体6.72L,若反应过程中溶液的体积保持不变( )
| A、最终得到7.8g的沉淀 |
| B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C、反应过程中得到6.72L的气体(标准状况下) |
| D、最终得到的溶液中c(NaCl)=2mol/L |
下列物质属于电解质的是( )
| A、Cu |
| B、CO2 |
| C、KNO3 |
| D、乙醇 |
下列离子方程式正确的是( )
| A、碳酸钙和盐酸反应 CO32-+2H+=H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液 Ba2++SO42-=BaSO4↓ |
| C、向稀盐酸溶液中加铁 3Fe十6H+=2Fe3++3H2↑ |
| D、向硝酸银溶液中加盐酸 Ag+十Cl-=AgCl↓ |