题目内容
10.用来鉴别C2H6和C2H4,又可除去C2H6中混有C2H4的方法是( )| A. | 通入酸性KMnO4溶液中 | B. | 通入足量的溴水中 | ||
| C. | 点燃 | D. | 通入H2后加热 |
分析 C2H6性质稳定,C2H4含有C=C双键,能发生加成反应和氧化反应,可用溴水除杂,注意除杂时不能引入新的杂质.
解答 解:A.乙烯被高锰酸钾氧化生成二氧化碳,C2H6不反应,则可以鉴别,不能用于除杂,会引入稀杂质,故A错误;
B.乙烯含有C=C双键,能与溴水发生加成反应生成二溴乙烷液体,C2H6不与溴水反应,所以可用溴水除去C2H6中混有的乙烯,也可鉴别,故B正确;
C.C2H6和乙烯都能燃烧,不能用点燃的方法除去C2H6中混有的乙烯,故C错误;
D.通入H2后加热,会混有氢气,不能达到除杂的目的,故D错误.
故选B.
点评 本题考查有机物的鉴别和除杂,题目难度不大,注意乙烯和乙烷性质的区别,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 第二周期元素的正化合价由+1→+7依次升高 | |
| B. | PH3在空气中可以自燃,根据元素周期律可以推知SiH4很难燃烧 | |
| C. | Cl的非金属性强于S,所以HClO3的酸性一定强于H2SO3 | |
| D. | Li的电子层数小于Al,但是Li的原子半径却却大于Al |
1.丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中正确的是( )
①新制氯水久置后→浅黄绿色消失 ②Cl2通入石蕊试液中→先变红后褪色 ③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去 ⑤氨气通入酚酞溶液中→红色 ⑥N2和O2放电条件下→直接生成红棕色气体.
①新制氯水久置后→浅黄绿色消失 ②Cl2通入石蕊试液中→先变红后褪色 ③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去 ⑤氨气通入酚酞溶液中→红色 ⑥N2和O2放电条件下→直接生成红棕色气体.
| A. | ①②③⑥ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
5.北京国家游泳馆“水立方”是在国内首次采用以钢材为支架,覆盖ETFE薄膜.ETFE是乙烯和四氟乙烯的共聚物,是一种轻质透明的新材料.关于该材料下列说法错误的是( )
| A. | ETFE极易分解,符合环保要求 | B. | ETFE韧性好,拉伸强度高 | ||
| C. | ETFE比玻璃轻、安全 | D. | ETFE是混合物,无固定的熔点 |
15.下列字母表示短周期中几种元素的位置,请回答下列问题.
(1)D2-的离子结构示意图为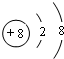 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为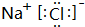 .
.
(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
| A | |||||||
| B | C | D | |||||
| E | F | G | H | I | |||
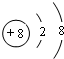 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为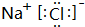 .
.(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
2.如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法正确的是( )
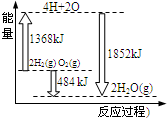

| A. | 该反应是吸热反应过程 | |
| B. | 由2molH2和1molO2变成4molH、2molO原子需要放出能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 | |
| D. | 4molH、2molO生成2molH2O(g),共放出484kJ能量 |
19.短周期元素H、X、Y、Z在周期表中的相对位置如图所示.已知X的最高正价和最低负价的代数和为0,下列推断正确的是( )
| X | Y | ||
| H | Z |
| A. | 常温下,含H的两种离子都能使水电离出的c•(H+)•c(OH-)增大 | |
| B. | Y的简单氢化物和Y的最高价含氧酸之间能发生氧化还原反应 | |
| C. | X的气态氢化物的热稳定性比Y的气态氢化物的热稳定性强 | |
| D. | 简单离子半径的大小顺序为H>Z>Y |
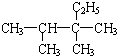 2,3,3-三甲基戊烷 (6)
2,3,3-三甲基戊烷 (6)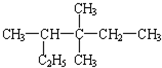 3,3,4-三甲基己烷.
3,3,4-三甲基己烷.