题目内容
19.表为长式周期表的一部分,其中的编号代表对应的元素.
试回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出上表中元素⑨原子的外围电子排布式3d54s1.
(2)元素③、④、⑦的电负性由大到小的顺序为F>O>S.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑥与元素①的氢氧化物有相似的性质.请写出元素①的氢氧化物与NaOH溶液反应的离子方程式:Be(OH)2+2OH-=BeO22-+2H2O.
(4)元素⑦形成的最高价氧化物分子的空间构型为平面三角形,该分子为非极性分子(填“极性”或“非极性”).
(5)元素④、⑤、⑧形成一种离子晶体的晶胞结构如图所示,则该晶体的化学式为KMgF3.

(6)往元素⑩的硫酸盐溶液中逐滴加入过量元素②的氢化物水溶液可生成配合物,不考虑空间构型,该配离子的结构可用示意图表示为
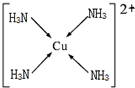 .
.
分析 根据图知,①-⑩分别是Be、N、O、F、Mg、Al、K、Cr、Cu元素;
(1)元素⑨原子的3d、4s能级上分别含有5、1个电子,其3d、4s能级电子为其外围电子,根据构造原理书写其外围电子排布式;
(2)同一周期元素,元素的电负性随着原子序数增大而增大,同一主族元素,元素的电负性随着原子序数增大而减小;
(3)氢氧化铍的性质和氢氧化铝的性质相似,根据氢氧化铝和NaOH反应书写氢氧化铍和NaOH溶液的反应方程式;
(4)元素⑦形成的最高价氧化物为SO3,SO3分子中S原子价层电子对个数=3+$\frac{6-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫空间构型,该分子结构对称,正负电荷重心重合;
(5)该晶胞中F原子个数=12×$\frac{1}{4}$=3,Mg原子个数=8×$\frac{1}{8}$=1,K原子个数为1,据此判断其化学式;
(6)硫酸铜和氨水反应生成铜铵络合物,在配离子中配位键由含有孤电子对的原子指向含有空轨道的原子.
解答 解:根据图知,①-⑩分别是Be、N、O、F、Mg、Al、K、Cr、Cu元素;
(1)元素⑨原子的3d、4s能级上分别含有5、1个电子,其3d、4s能级电子为其外围电子,根据构造原理书写其外围电子排布式为3d54s1,故答案为:3d54s1;
(2)同一周期元素,元素的电负性随着原子序数增大而增大,同一主族元素,元素的电负性随着原子序数增大而减小,所以其电负性大小顺序是F>O>S,故答案为:F>O>S;
(3)氢氧化铍的性质和氢氧化铝的性质相似,根据氢氧化铝和NaOH反应书写氢氧化铍和NaOH溶液的反应方程式为Be(OH)2+2OH-=BeO22-+2H2O,故答案为:Be(OH)2+2OH-=BeO22-+2H2O;
(4)元素⑦形成的最高价氧化物为SO3,SO3分子中S原子价层电子对个数=3+$\frac{6-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫空间构型为平面三角形,该分子结构对称,正负电荷重心重合,所以为非极性分子,故答案为:平面三角形;非极性;
(5)该晶胞中F原子个数=12×$\frac{1}{4}$=3,Mg原子个数=8×$\frac{1}{8}$=1,K原子个数为1,据此判断其化学式为KMgF3,故答案为:KMgF3;
(6)硫酸铜和氨水反应生成铜铵络合物,在配离子中配位键由含有孤电子对的原子指向含有空轨道的原子,铜铵配离子中N原子含有孤电子对、Cu原子含有空轨道,所以该配离子结构为 ,故答案为:
,故答案为: .
.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、配位键、分子空间构型判断、元素周期律等知识点,侧重考查学生分析判断、空间想象、计算及知识综合运用能力,注意配位键的表示方法,题目难度不大.

 新课标同步训练系列答案
新课标同步训练系列答案| A. | 11H | B. | 12H | C. | -10e | D. | 01n |
| A. | 2.24b L | B. | $\frac{c-a}{71}$×22.4L | C. | $\frac{c-a}{17}$×22.4L | D. | $\frac{a-c}{35.5}$×22.4L |
| A. | 从海水中可以得到NaCl,电解熔融NaCl可获得Cl2 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 海水蒸发制海盐的过程只发生了化学变化 | |
| D. | 利用电解的方法可以从海水中获取淡水 |
| A. | NaCl | B. | NaClO | C. | NaOH |
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石蜡油的裂化 | D. | 铝热反应 |