题目内容
13. 某工艺原理示意图如下.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.
某工艺原理示意图如下.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.发生器中生成ClO2的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
分析 氯酸钠(NaClO3)与盐酸发生氧化还原反应,生成ClO2,同时生成氯气、水,以此解答该题.
解答 解:NaClO3和HCl发生氧化还原反应,NaClO3被还原生成ClO2,HCl被氧化生成Cl2,同时生成水,反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,
故答案为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
点评 本题考查元素化合物知识,为高频考点,侧重考查学生的分析能力,本题主要把握元素的化合价的变化以及物质的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法不正确的是( )
| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
5.氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是(注意:HCl与NH3极易反应而生成白烟)( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1molN2有6mol电子转移 | D. | 该反应属于复分解反应 |
2.下列物质的水溶液因水解而呈酸性的是( )
| A. | NaCl | B. | MgCl2 | C. | NaHCO3 | D. | H2CO3 |
11.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用如图装置制取高纯度的苯甲酸甲酯.
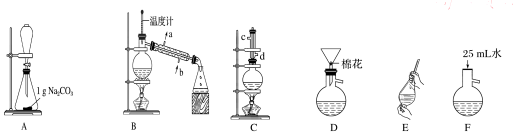
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.

| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.

 如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.
如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.