题目内容
6.下列说法中正确的是( )| A. | 处于最低能量的原子叫做基态原子 | |
| B. | 在元素周期表中,s区,d区和ds区的元素都是金属 | |
| C. | 同一原子中,1s,2s,3s电子的能量逐渐减小 | |
| D. | 同一原子中,2p,3p,4p能级的轨道依次增多 |
分析 A.基态原子是处于最低能量的原子;
B.s区的H为非金属元素;
C.能级符号相同,能层越大,能量越高;
D.同一能级的轨道数相同.
解答 解:A.处于最低能量的原子叫做基态原子,故A正确;
B.s区的H为非金属元素,故B错误;
C.能级符号相同,能层越大,电子能量越高,所以1s、2s、3s电子的能量逐渐增大,故C错误;
D.同一原子中,2p、3p、4p能级的轨道数相等,都为3,故D错误;
故选A.
点评 本题主要考查了原子电子排布式、能层与能级的关系,难度不大,注意知识的运用.

练习册系列答案
相关题目
16.A、B、C、D、E是同周期的五种主族元素.A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物均呈酸性,且酸性C>D,E是这五种元素中简单离子半径最小的元素,它们的原子序数由小到大的顺序是( )
| A. | B<A<D<C<E | B. | E<B<A<D<C | C. | B<A<E<D<C | D. | E<D<C<B<A |
17.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | 稀有气体原子的最外层电子数都为8 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第三周期第ⅡA族 |
14.下列说法正确的是( )
| A. | IA族元素的电负性从上到下逐渐减小,而ⅦA族元素的第一电离能从上到下逐渐增大 | |
| B. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| C. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的量度 | |
| D. | NaH的存在不能支持可将氢元素放在ⅦA的观点 |
1.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_8^{18}O$ | |
| D. | 丙烯的结构简式为:CH3CHCH2. |
11.下列关于电解KNO3溶液时的叙述正确的是( )
| A. | NO3-向阴极移动,K+向阳极移动,分别在对应的极上析出 | |
| B. | 随电解的进行,溶液的pH减小 | |
| C. | OH-向阳极移动,阳极附近溶液显碱性 | |
| D. | 阴极上H+得电子被还原成H2,促进水的电离平衡正向移动,富集下来的OH-使得阴极附近溶液呈碱性 |
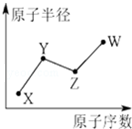 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: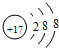 ;
;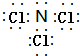 ;
; +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$ ═CH-M+HX(X为卤素原子,M为烃基或含酯基的取代基等)
═CH-M+HX(X为卤素原子,M为烃基或含酯基的取代基等)

 $→_{Pd}^{CO}$
$→_{Pd}^{CO}$ (R,R′为烃基),试写出以苯和丙烯(CH2═CH-CH3)为原料,合成
(R,R′为烃基),试写出以苯和丙烯(CH2═CH-CH3)为原料,合成 的路线流程图(无机试剂任选),合成路线流程示例如下:
的路线流程图(无机试剂任选),合成路线流程示例如下: