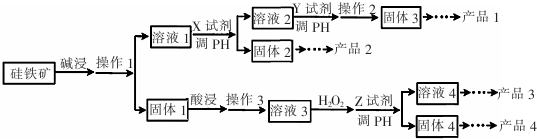
题目内容
17.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )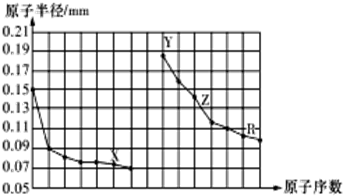
| A. | 同周期元素中,X氢化物的沸点最高 | |
| B. | 简单离子半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素.
A.X为O元素,非金属性比F弱,第二周期中HF的稳定性最强,故A错误;
B.X为O元素,Y为Na元素,Z为Al元素,简单离子的半径:O2->Na+>Al3+,故B正确;
C.Y、Z、R对应的最高价氧化物的水化物分别为:NaOH、Al(OH)3、H2SO4,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、硫酸反应,故C正确;
D.工业上电解熔融的Al2O3冶炼Al,故D正确;
故选A.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.

练习册系列答案
相关题目
8.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等.下列说法正确的是( )
| A. | H2O2分子的空间构型为直线形 | |
| B. | CO2分子为非极性分子 | |
| C. | BF3分子中的B原子满足8电子稳定结构 | |
| D. | CH3COOH分子中C原子均为sp2杂化 |
9.利用表中提供的仪器和药品,能达到相应实验目的是( )
| 选项 | 仪器 | 药品 | 实验目的 |
| A | 烧杯、玻璃棒、胶头滴管 | FeCl3溶液、NaOH溶液 | 制Fe(OH)3胶体 |
| B | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的二氧化碳、蒸馏水 | 模拟喷泉实验 |
| C | 酸式滴定管、锥形瓶、铁架台(带铁夹) | 已知浓度的盐酸,待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 酒精灯、玻璃棒、蒸发皿、三脚架 | NaCl溶液 | 蒸发溶液得到晶体 |
| A. | A | B. | B | C. | C | D. | D |
5.下列反应不能通一步反应实现的是( )
| A. | N2→NO | B. | S→SO3 | C. | Fe→FeCl2 | D. | Fe→FeCl3 |
7.有100mL氯化镁和氯化铝的混合溶液,其中c (Mg2+)为0.1mol•L-1,c(Cl-)为0.65mol•L-1.要使Mg2+全部转化为沉淀分离出来,至少需加2mol•L-1NaOH溶液的体积为( )
| A. | 40 mL | B. | 72 mL | C. | 128 mL | D. | 20 mL |