题目内容
1.过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基蒽醌法生产.生产过氧化氢的工艺:
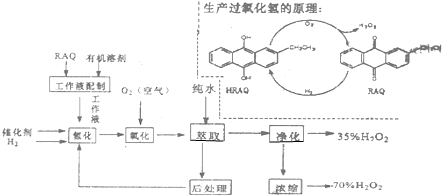
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为100%.
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇替代呢?否,因为乙醇与过氧化氢溶液及烷基蒽醌等都互溶,无法萃取,难于与工作液分离.
(3)为了提高经济效益,该工艺氢化反应中,除了加催化剂外,还可采用的措施是AB.
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是回收RAQ(及HRAQ)及有机溶剂并循环使用.
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是减压蒸馏.
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式Cu+2H++H2O2=Cu2++2H2O.
分析 工业采用烷基蒽醌法生产过氧化氢的原理:RAQ与有机溶剂形成工作液,氢气和催化剂与工作液作用形成HRAQ,HRAQ进行氧化生成过氧化氢和RAQ,通过萃取净化得到35%的H2O2,通过减压蒸馏由35%的H2O2得到70%的H2O2.
(1)化合反应原子利用率是100%;
(2)过氧化氢溶液与工作液分离通过萃取实现,根据萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应分析;
(3)RAQ与有机溶剂形成工作液,氢气和催化剂与工作液作用形成HRAQ,适当加热、加压能提高反应速率产率,提高经济效益;
(4)HRAQ进行氧化生成过氧化氢和RAQ,通过“后处理”,回收RAQ(及HRAQ)及有机溶剂并循环使用;
(5)过氧化氢受热易分解,由35%的H2O2得到70%的H2O2可采取减压蒸馏;
(6)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水.
解答 解:(1)工业采用烷基蒽醌法生产过氧化氢的原理:RAQ与有机溶剂形成工作液,氢气和催化剂与工作液作用形成HRAQ,HRAQ进行氧化生成过氧化氢和RAQ,本质为H2+O2=H2O2,为无机中的化合反应,原子利用率为100%,
故答案为:100%;
(2)液态烷烃和酯类与过氧化氢不互溶,过氧化氢溶液与工作液分离通过萃取实现,乙醇为有机物,与与过氧化氢溶液及烷基蒽醌等都互溶,无法通过萃取操作,与工作液分离,所以不可用乙醇替代液态烷烃和酯类,
故答案为:否,因为乙醇与过氧化氢溶液及烷基蒽醌等都互溶,无法萃取,难于与工作液分离;
(3)RAQ与有机溶剂形成工作液,氢气和催化剂与工作液作用形成HRAQ,适当加热,温度高反应速率加快,但过氧化氢易分解,不能温度过高,反应本质为H2+O2=H2O2,加压利于产物的生成,增大工作液中有机溶剂的量,增加成本,不能提高产率,所以不选,
故答案为:AB;
(4)采用烷基蒽醌法生产过氧化氢,RAQ与有机溶剂形成工作液,氢气和催化剂与工作液作用形成HRAQ,HRAQ进行氧化生成过氧化氢和RAQ,通过“后处理”,回收RAQ(及HRAQ)及有机溶剂并循环使用,
故答案为:回收RAQ(及HRAQ)及有机溶剂并循环使用;
(5)因为H2O2的沸点比水高,但受热易分解,浓缩H2O2溶液时,不能加热,不能加压,应进行减压蒸馏,故答案为:减压蒸馏;
(6)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水,即Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O.
点评 本题考查工业采用烷基蒽醌法生产过氧化氢工艺,要求学生具有分析和解决问题的能力,注意把握实验操作原理,把握题给信息,掌握实验操作方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 聚乙烯是由乙烯加聚生成的纯净物 | |
| B. | 蛋白质和淀粉水解的最终产物都是氨基酸 | |
| C. | 油脂、纤维素、淀粉在一定条件下均可发生水解反应 | |
| D. | 蛋白质、纤维素、蔗糖都是高分子化合物 |
| A. | 向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色 | |
| B. | 向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸,能使溶液变为棕黄色 | |
| D. | 将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅 |
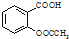 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点 (℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙烯水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)合成阿斯匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离.
另一种改进的提纯方法,称为重结晶提纯法.方法如下:

(4)改进的提纯方法中加热回流的装置如图所示

①使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
②重结晶提纯法所得产品的有机杂质要比原方案少的原因水杨酸易溶于乙酸乙酯,冷却结晶时大部分水杨酸仍溶解在乙酸乙酯中很少结晶出来.
(5)检验产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色,则含水杨酸.
(6)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
 硝基苯是制备多种染料和医药的重要中间体,应用极为广泛:用苯、浓硝酸和浓硫酸混合制备硝基苯的装置如图所示:反应物和产物的相关数据列表如下
硝基苯是制备多种染料和医药的重要中间体,应用极为广泛:用苯、浓硝酸和浓硫酸混合制备硝基苯的装置如图所示:反应物和产物的相关数据列表如下| 沸点/℃ | 密度/(g.cm-3) | 水中溶解性 | |
| 苯 | 80.1 | 0.877 | 难溶 |
| 硝基苯 | 210.9 | 1.21 | 难溶 |
(1)写出制取硝基苯的反应方程式
 .
.(2)该装置中,冷凝管的作用是冷凝回流.
(3)制备硝基苯时,在三颈瓶中加入20mL的苯,再通过分液漏斗滴加已冷却的混酸溶液(由20mL浓硝酸和22mL浓硫酸在锥形瓶中混合而成),将三颈瓶置于50-55℃的水浴中,反应时间为1小时.因硝化反应为放热反应,当温度超过60℃时,为避免副反应发生,可向水浴中加入冰水冷却.
(4)反应结束后,冷却反应混合物,通过分液漏斗分离出有机层,依次用蒸馏水、5%的NaOH溶液和蒸馏水洗涤,再用无水CaCl2干燥后,得到粗产品.
①硝基苯有毒,该实验最好在通风橱中迸行.
②有机层用5%的NaOH溶液洗涤的目的是除去粗产品中残留的酸.
③有机层在分液漏斗中洗涤静置后,有机层处于下(填“上”或下”)层;放液时若发现液体流不下来,其可能的原因除分液漏斗的活塞堵塞之外,还有分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)..
(5)粗产品蒸馏提纯时,下面装置中温度计位置正确的是C,可能会导致收集到的产品中混有高沸点杂质的装置是D.

(6)若该实验制备得到纯硝基苯18g,则该实验中硝基苯的产率是65.08%.
| A. | 金属钠在自然界中能以游离态存在 | B. | 钠燃烧时发出黄色的火焰 | ||
| C. | 钠能与S、Cl2等非金属反应 | D. | 钠在空气中燃烧生成过氧化钠 |
| A. | Na+H2O | B. | Fe+H2O(g) | C. | CO2+H2O | D. | Na2O2+H2O |
