题目内容
2.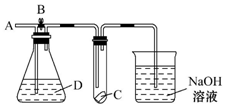 如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )
如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
分析 A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐退色,说明C处布条是湿润的;关闭B阀时,C处的红布条看不到明显现象,说明洗气瓶D中装的物质能完全吸收氯气,以此解答.
解答 解:A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐退色,说明C处布条是湿润的;关闭B阀时,C处的红布条看不到明显现象,说明洗气瓶D中装的物质能完全吸收氯气.
A.浓硫酸与氯气不反应,不能吸收氯气,故A错误;
B.氢氧化钠溶液与氯气反应能吸收氯气,故B正确;
C.浓盐酸不与氯气反应,不能吸收氯气,故C错误;
D.氯气在饱和食盐水中溶解度很小,不能吸收氯气,故D错误;
故选B.
点评 本题考查氯气的性质,明确装置中D的作用是解答本题的关键,注意干燥的氯气不具有漂白性,题目难度不大.

练习册系列答案
相关题目
12.将1.28gCu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体448mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
| A. | 112 mL | B. | 224 mL | C. | 336 mL | D. | 448 mL |
17.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
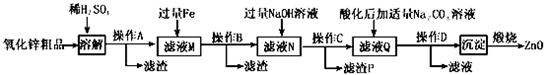
已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)操作A所用的玻璃仪器有烧杯、漏斗和玻璃棒.
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.

已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.
7.如图为空气成分示意图(按体积计算),其中“a”代表的是( )


| A. | 氧气 | B. | 氮气 | C. | 二氧化碳 | D. | 稀有气体 |
14.为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸30.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如表.
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=2:1;
(2)盐酸的物质的量浓度c(HCl)=2.5mol/L.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的体积(mL) | 672 | 840 | 896 | 672 |
(2)盐酸的物质的量浓度c(HCl)=2.5mol/L.
11.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①少量Ca(OH)2投入过量NaHCO3溶液中
②过量NaOH溶液和明矾溶液混合
③金属钠投入到FeCl2中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2.
①少量Ca(OH)2投入过量NaHCO3溶液中
②过量NaOH溶液和明矾溶液混合
③金属钠投入到FeCl2中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2.
| A. | ①②③④⑤ | B. | 只有①④⑤ | C. | 只有②③ | D. | 只有③④ |
12.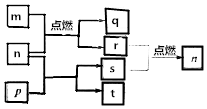 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |

 ②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).
②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点). .
.