题目内容
12.将1.28gCu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体448mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )| A. | 112 mL | B. | 224 mL | C. | 336 mL | D. | 448 mL |
分析 由HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,结合电子守恒可知,Cu失去电子数目等于O2得到电子的数目,以此进行计算.
解答 解:由HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,结合电子守恒可知,Cu失去电子数目等于O2得到电子的数目,设通入的氧气的体积为x,则
$\frac{1.28g}{64g/mol}$×(2-0)=$\frac{x}{22.4L/mol}$×2×(2-0),
解得x=0.224L=224mL,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、电子守恒为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
3.氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如右图所示,回答以下问题:
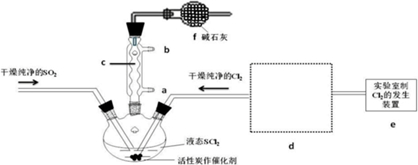
(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解
(4)下列四种制备SO2的方案中最佳选择是丁
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂.
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏
(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.

(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解
(4)下列四种制备SO2的方案中最佳选择是丁
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 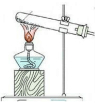 |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏
(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
20. 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层 | |
| D. | 长玻璃导管只有导气的作用 |
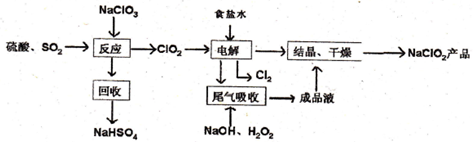
7.铬酸钙(CaCrO4)俗称钙铬黄,溶于水.广泛用作氧化剂、腐蚀抑制剂、颜料等.铬铁矿中铬的含量为19.5%,其主要成分为 FeO•Cr2O3,还含Fe2O3、SiO2、Al2O3等杂质,以该铬铁矿为原料制备钙铬黄的工艺流程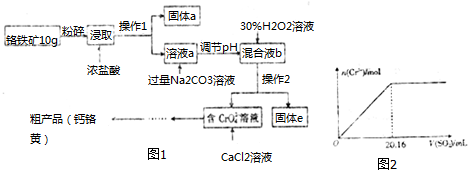
如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
(1)将铬铁矿粉碎的目的是增大接触面积、提高浸取率.
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
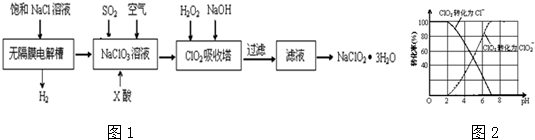
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].

如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].
4.电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液.请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,该过程中调节溶液的pH为5,则c(Fe3+)为:4.0×10-11mol•L-1.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
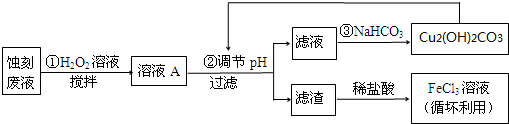
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:Fe3+、Fe2+和Cu2+.
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:抑制氯化铁水解.
③步骤①中加入H2O2溶液的目的是:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
④已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是:[3.2,4.7)或3.2≤pH<4.7.
⑤写出步骤②中生成CO2的离子方程式:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3难溶于水)
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,该过程中调节溶液的pH为5,则c(Fe3+)为:4.0×10-11mol•L-1.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:

①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:Fe3+、Fe2+和Cu2+.
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:抑制氯化铁水解.
③步骤①中加入H2O2溶液的目的是:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
④已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
⑤写出步骤②中生成CO2的离子方程式:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3难溶于水)
2.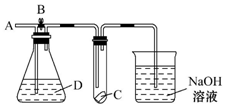 如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )
如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )
 如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )
如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |