题目内容
16.自来水常用氯气进行消毒,某实验室用自来水配制下列物质的溶液,会产生明显药品变质问题的是:①FeCl2②AgNO3 ③Na2CO3 ④NaOH⑤石蕊试液( )| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤ | D. | 全部 |
分析 氯水中含有H+、Cl2、HClO、ClO-、Cl-等微粒,Ag+与Cl-反应,H+与弱酸根离子、氢氧根离子反应,亚铁离子具有还原性,能被氧化,以此来解答.
解答 解:①因氯水中含有Cl2,Cl2能与FeCl2发生氧化还原反应,则产生明显的药品变质问题,故①错误;
②因氯水中含有Cl-,Cl-能与Ag+生成AgCl,则产生明显的药品变质问题,故②错误;
③因氯水中含有H+,H+能与CO32-反应生成水和CO2,则产生明显的药品变质问题,故③错误;
④因氯水中含有H+,H+能与OH-反应生成水,则产生明显的药品变质问题,故④错误;
⑤氯水中含HClO,具有漂白性,能使石蕊褪色而变质,故⑤错误;
故选D.
点评 本题考查氯水的性质,为高频考点,把握氯水的成分、发生的反应为解答的关键,侧重分析与应用能力的考查,注意氯水中含氯气、HClO,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
6.下列离子方程式书写正确的是( )
| A. | 向小苏打溶液中加入少量石灰水:HCO3-+OH-+Ca2+=CaCO3↓+2H2O | |
| B. | 向烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42--=BaSO4↓ |
7.关于如图所示原电池装置中,叙述正确的是( )


| A. | 铜片上有气泡 | B. | 铜片为负极 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 该装置将电能转化为化学能 |
11.在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,此混合气体中C和O两种原子的物质的量之比为( )
| A. | 3:4 | B. | 4:3 | C. | 2:1 | D. | 1:2 |
1.下列关于溶液和胶体的叙述,正确的是( )
| A. | 溶液是呈电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 胶体的分散质可以通过过滤从分散剂中分离出来 | |
| D. | 胶体与其他分散系最本质的区别是:胶体粒子直径介于(1---100 )nm之间 |
5.制取纯净的一氯乙烷最好采用的方法是( )
| A. | 乙烷和 Cl2反应 | B. | 乙烯和 Cl2反应 | ||
| C. | 乙烯和 HCl 反应 | D. | 乙烯和 H2、Cl2 反应 |
6.含有Na+浓度为0.5mol•L-1某无色透明澄清溶液中,还可能含有表中的若干种离子.
已知:
①H2SiO3为不溶于水的胶状沉淀,加热时分解为两种氧化物;
②CaSiO3 BaSiO3不溶于水.
现取该溶液100mL进行如下实验:
回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是Ca2+、Ba2+
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=CO2↑+H2O
(3)据实验Ⅲ可知一定不存在的离子是SO42-
(4)某同学认为该溶液中一定存在K+,其理由是若无钾离子,阴离子带的电荷总数大于阳离子所带的电荷总数;据上述数据,c(K+)应不小于0.8mol/L.
| 阳离子 | K+ | Fe2+ | Ca2+ | Ba2+ |
| 阴离子 | NO3- | CO3-2 | SiO32- | SO42- |
①H2SiO3为不溶于水的胶状沉淀,加热时分解为两种氧化物;
②CaSiO3 BaSiO3不溶于水.
现取该溶液100mL进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ca2+、Ba2+
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=CO2↑+H2O
(3)据实验Ⅲ可知一定不存在的离子是SO42-
(4)某同学认为该溶液中一定存在K+,其理由是若无钾离子,阴离子带的电荷总数大于阳离子所带的电荷总数;据上述数据,c(K+)应不小于0.8mol/L.
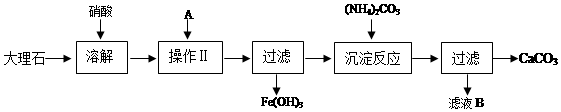
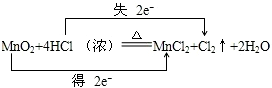 .
.