题目内容
14.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:
已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)为了加快反应Ⅰ的速率,可以采取的措施是升高温度、不断搅拌、将矿渣粉碎、增大硫酸的浓度(写2点).
(3)固体混合物A中的成分是SiO2、Cu.
(4)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号);写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(5)x对应的数值范围是3.2≤pH<4.0.
(6)用NaClO调pH,生成沉淀B的反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(7)洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤,原因是CuSO4可溶于水,冰水可以减少CuSO4晶体的损失.
分析 矿渣加入稀硫酸氧化亚铜、氧化铝、氧化铁溶解,二氧化硅不溶所以固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+,滤液中主要是Al3+、Fe2+、Cu2+,加入NaClO具有氧化性,氧化亚铁离子为铁离子,同时调节溶液PH使铁离子、铝离子沉淀完全,根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围是:3.7≤pH<4.0,就可以沉淀氢氧化铁;y范围是:5.2≤pH<5.4,就可以沉淀氢氧化铝;最后得到氯化铜、硫酸铜溶液,电解法获取Cu吗,
(1)Cu2O在酸性条件下发生自身氧化还原反应;
(2)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等可以加快反应速率,根据影响反应速率的因素:温度、浓度、催化剂、接触面积等来回答;
(3)固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;
(4)由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+;
(5)根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围是:3.2≤pH<4.0,目的是沉淀氢氧化铁;
(6)用NaCl0调pH,生成沉淀B为氢氧化铁,据氧化还原反应规律来书写离子方程式;
(7)硫酸铜溶于水溶解度随温度降低减小.
解答 解:(1)Cu2O在酸性条件下发生自身氧化还原反应,反应的离子方程式为:Cu2O+2H+=Cu+Cu2++H2O,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;
(2)由于矿渣为固体,所以为了加快反应Ⅰ的速率,可以采取的措施是将固体粉碎;也可以适当升高反应的温度;或增大反应物H2SO4的浓度等措施
故答案为:升高温度、不断搅拌、将矿渣粉碎、增大硫酸的浓度;
(3)SiO2是酸性氧化物,不能与酸发生反应;其他金属氧化物Cu2O、Al2O3、Fe2O3与硫酸发生反应,因此发生反应Ⅰ后过滤出的固体混合物A中的成分是SiO2、Cu,
故答案为:SiO2、Cu;
(4)由于发生了反应,2Fe3++Cu=Cu2++2Fe2+,溶液中铁元素的存在形式为:Fe2+;
故答案为:Fe2+;2Fe3++Cu=Cu2++2Fe2+;
(5)调节PH=x,目的是生成沉淀氢氧化铁,PH应该大于3.2,小于4.0,x对应的数值范围是3.2≤pH<4.0,
故答案为:3.2≤pH<4.0;
(6)用NaClO调pH,生成沉淀B为氢氧化铁,该反应的离子方程式是:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
(7)洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤,原因是CuSO4溶液溶解于水,而且温度越高,溶解度越大.若用冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失,
故答案为:CuSO4可溶于水,冰水可以减少CuSO4晶体的损失.
点评 本题考查了金属回收和环境保护方法,流程分析判断和物质性质分析,掌握物质性质和题干信息是关键,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 | |
| B. | 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 | |
| C. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
| A. | 有化学键被破坏的变化不一定是化学变化 | |
| B. | 金属元素与非金属元素原子间形成的化学键不一定是离子键 | |
| C. | 乙炔分子中,σ键与π键数目之比为1:1 | |
| D. | 金刚石中碳原子采取sp3杂化,12g金刚石中含2mol 碳碳单键 |
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>③>① |
| A. | 等于13.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
| A. | 具有银白色金属光泽 | B. | 良好的导热性 | ||
| C. | 较强的还原性 | D. | 优良的导电性 |
 +H2O$→_{②H+}^{①OH-,△}$
+H2O$→_{②H+}^{①OH-,△}$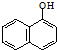 +CO2↑+CH3NH2,
+CO2↑+CH3NH2,则下列说法正确的是( )
| A. | 西维因是一种芳香烃 | |
| B. | 西维因苯环上一溴取代产物有4种情况 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化下1mol西维因最多能与6molH2加成 |
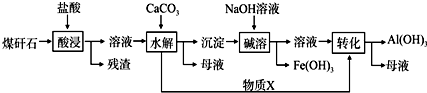
 .该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
.该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.