题目内容
某研究性学习小组的同学想通过如图1实验装置探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
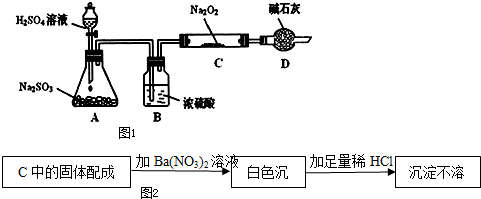
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是 .装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是 .
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1: ;
假设2:只有Na2SO4;
假设3:既有Na2SO3又有Na2SO4.
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式: .
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如图2实验:
得出结论:C中固体产物只有Na2SO4.该方案是否合理?答: .(填“是”或“否”)理由是 .
(3)乙同学为证明假设3成立,设计如下实验.实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有 ;
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有 .

Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:
假设2:只有Na2SO4;
假设3:既有Na2SO3又有Na2SO4.
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如图2实验:
得出结论:C中固体产物只有Na2SO4.该方案是否合理?答:
(3)乙同学为证明假设3成立,设计如下实验.实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有
考点:性质实验方案的设计
专题:实验设计题
分析:Ⅰ.水能和过氧化钠反应生成氢氧化钠和氧气,干扰实验检验,装置B中浓硫酸可以吸收水蒸气;空气中二氧化碳、水能够与过氧化钠反应,干扰装置C中二氧化硫与过氧化钠的反应;
Ⅱ.根据假设2、假设3进行判断假设1的内容;
(1)假设2生成了硫酸钠,反应物为过氧化钠和二氧化硫,据此写出反应的化学方程式;
(2)硝酸根离子在酸性条件下能够将亚硫酸钡氧化成硫酸钡,干扰的检验;
(3)②亚硫酸钡和硫酸钡都是不溶物,只能证明C中至少含有亚硫酸钠和硫酸钠中的一种;
③部分溶解的为亚硫酸钡,不溶物为硫酸钡,从而证明C中含有亚硫酸钠和硫酸钠.
Ⅱ.根据假设2、假设3进行判断假设1的内容;
(1)假设2生成了硫酸钠,反应物为过氧化钠和二氧化硫,据此写出反应的化学方程式;
(2)硝酸根离子在酸性条件下能够将亚硫酸钡氧化成硫酸钡,干扰的检验;
(3)②亚硫酸钡和硫酸钡都是不溶物,只能证明C中至少含有亚硫酸钠和硫酸钠中的一种;
③部分溶解的为亚硫酸钡,不溶物为硫酸钡,从而证明C中含有亚硫酸钠和硫酸钠.
解答:
Ⅰ.A装置中产生的二氧化硫气体中含有水蒸气,水能和过氧化钠反应生成氢氧化钠和氧气,B装置中浓硫酸具有吸水性,可吸收水蒸气;
空气中含有二氧化碳和水蒸气,碱石灰是干燥剂,所以能吸收水分,防止水蒸气的干扰,碱石灰能和二氧化碳反应,防止二氧化碳的干扰,所以装置D的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,
故答案为:防止水蒸气与Na2O2反应;防止空气中的水和CO2进入玻璃管C;
Ⅱ.根据题给假设2、假设3可知假设1应该为:只有Na2SO3,
故答案为:只有Na2SO3;
(1)若假设2成立,二氧化硫和过氧化钠反应生成硫酸钠,反应的化学方程式为:Na2O2+SO2=Na2SO4,
故答案为:SO2+Na2O2=Na2SO4;
(2)硝酸有强氧化性,加入盐酸后硝酸根离子在酸性条件下能把亚硫酸根离子氧化成硫酸根离子,所以该方案不合理,
故答案为:否;NO3-在酸性条件下可将BaSO3氧化成BaSO4或硝酸根在酸性条件下具有强氧化性;
(3)乙同学为证明假设3成立,设计如下实验:实验步骤和结论为:①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,由于硫酸钡和亚硫酸钡均为不溶于水的白色固体,则证明C中固体产物中Na2SO3和Na2SO4至少有一种,
故答案为:Na2SO3和Na2SO4至少有一种;
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,溶解的为亚硫酸钡,不溶的为硫酸钡,则证明C中固体产物中既有Na2SO3又有Na2SO4,
故答案为:既有Na2SO3又有Na2SO4.
空气中含有二氧化碳和水蒸气,碱石灰是干燥剂,所以能吸收水分,防止水蒸气的干扰,碱石灰能和二氧化碳反应,防止二氧化碳的干扰,所以装置D的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,
故答案为:防止水蒸气与Na2O2反应;防止空气中的水和CO2进入玻璃管C;
Ⅱ.根据题给假设2、假设3可知假设1应该为:只有Na2SO3,
故答案为:只有Na2SO3;
(1)若假设2成立,二氧化硫和过氧化钠反应生成硫酸钠,反应的化学方程式为:Na2O2+SO2=Na2SO4,
故答案为:SO2+Na2O2=Na2SO4;
(2)硝酸有强氧化性,加入盐酸后硝酸根离子在酸性条件下能把亚硫酸根离子氧化成硫酸根离子,所以该方案不合理,
故答案为:否;NO3-在酸性条件下可将BaSO3氧化成BaSO4或硝酸根在酸性条件下具有强氧化性;
(3)乙同学为证明假设3成立,设计如下实验:实验步骤和结论为:①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,由于硫酸钡和亚硫酸钡均为不溶于水的白色固体,则证明C中固体产物中Na2SO3和Na2SO4至少有一种,
故答案为:Na2SO3和Na2SO4至少有一种;
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,溶解的为亚硫酸钡,不溶的为硫酸钡,则证明C中固体产物中既有Na2SO3又有Na2SO4,
故答案为:既有Na2SO3又有Na2SO4.
点评:本题通过过氧化钠与二氧化硫的反应,考查了性质实验方案的设计方法,题目难度中等,正确理解题干信息及实验原理为解答关键,注意掌握性质实验方案的设计与评价方法,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则ω g R原子完全转化为R2-时,含有电子的物质的量是( )
A、
| ||
B、
| ||
C、ω(
| ||
D、ω(
|
下列电离方程式中,正确的是( )
| A、HClO4?H++ClO4- |
| B、H2CO3?2H++CO32- |
| C、HCO3-+H2O?CO32-+H3O+ |
| D、NH3?H2O═NH4++OH- |
将空气中氮气转化成氮的化合物的过程称为固氮.下列选项中能实现人工固氮的是( )
| A、闪电 | B、电解饱和食盐水车间 |
| C、根瘤菌 | D、合成氨车间 |
mA(g)+nB(g)?pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率VA:VB:VC:VD=m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应.
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率VA:VB:VC:VD=m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应.
| A、③④⑤⑥ | B、②③④⑥ |
| C、①③④⑤ | D、①③④⑥ |
化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
A、Mg2+的结构示意图: |
B、Na2S的电子式: |
| C、氨气的空间结构:三角形 |
| D、乙烯的结构简式:(CH2)2 |
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究. 为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验.
为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验.