题目内容
根据下面信息,判断下列叙述中正确的是 ( )
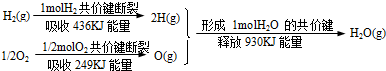

| A.1molH2和0.5molO2所具有的总能量低于1mol气态H2O所具有的总能量 |
| B.氢气跟氧气反应生成水的同时吸收能量 |
| C.1molH2跟1/2molO2反应生成1molH2O(l)释放能量一定是245kJ |
| D.2molH2(g)跟1molO2(g)反应生成2molH2O(g)释放能量490kJ |
D
试题分析:依据反应的热效应=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ;所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol。A、氢气与氧气反应生成水是放热反应,根据能量守恒,1molH2 和0.5molO2所具有的总能量高于1mol气态H2O所具有的总能量,故A错误;B、氢气与氧气反应生成水的同时放出能量,故B错误;C、1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,气态水变为液态水时放出热量,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(l),释放能量大于245KJ,故C错误;D、依据反应的热化学方程式H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,可知同乘以2得到2H2(g)+O2(g)=2H2O(g)△H=-490KJ/mol,故D正确;故选D。

练习册系列答案
相关题目
 (g)+3H2(g)→
(g)+3H2(g)→ (g)的△H
(g)的△H CO2(g)+4H2(g)
CO2(g)+4H2(g)
 H2(g)+
H2(g)+  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表: ×△H 2+
×△H 2+ CO2(g)+2H2O(l) ΔH1=-Q1
CO2(g)+2H2O(l) ΔH1=-Q1