题目内容
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
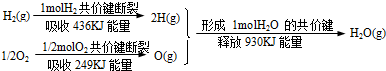
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+ O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
②
 H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1③H2(g)+
 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)
 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
Ⅰ.N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-1135kJ·mol-1
Ⅱ.(1) 小于;0.015 mol/(L·s);(2) A 、C;(3)通入氧气、增大压强;(4)720 ;(5)25%
Ⅱ.(1) 小于;0.015 mol/(L·s);(2) A 、C;(3)通入氧气、增大压强;(4)720 ;(5)25%
试题分析:Ⅰ①+②×4-③×2整理可得N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-1135kJ·mol-1 ;Ⅱ(1)由已知条件可知升高温度化学平衡常数减小,说明升高温度门牌号逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应为放热反应,即ΔH<0。从0~2 s内用O2表示该反应的平均速率为v(O2)= (0.100-0.040)mol÷2L÷2s="0.015" mol/(L·s);(2)A.因为反应是在恒容的密闭容器中发生的,只有NO2是红棕色,其它气体都是无色的,若容器内颜色保持不变,说明各种气体的物质的量不变,而反应是个反应前后气体体积不等的反应,所以可证明反应达到平衡状态。正确。B.在任何时刻都存在关系:2v逆(NO)=v正(O2)。因此不能证明反应达到平衡状态。错误。C.由于反应是个反应前后气体体积不等的反应,若未达到平衡,则容器内气体的压强就会发生变化,所以容器内压强保持不变,则该反应达到了平衡状态。正确。D.在反应前后气体的质量不变,容器的容积也不变,所以任何时刻容器内气体的密度都保持不变。故不可作为判断平衡的标志。错误。选项为A、C。(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有通入氧气来增大氧气的浓度或增大体系的压强的方法;(4)在上述体系中化学反应平衡常数为
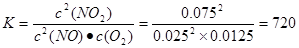 .由于化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变。(5)在反应开始时c(NO2)=0.1mol/L;假设在反应过程中c(O2)=xmol/L,则当反应得到平衡时各种物质的浓度分别是c(NO2)=(0.1-2x)mol/L; c(NO)=" 2xmol/L;" c(NO2)=xmol/L。根据化学平衡常数的含义可得
.由于化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变。(5)在反应开始时c(NO2)=0.1mol/L;假设在反应过程中c(O2)=xmol/L,则当反应得到平衡时各种物质的浓度分别是c(NO2)=(0.1-2x)mol/L; c(NO)=" 2xmol/L;" c(NO2)=xmol/L。根据化学平衡常数的含义可得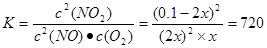 。解得x=0.0125mol/L,所以NO2的转化率为(2×0.0125mol/L)÷0.1mol/L×100%=25%.
。解得x=0.0125mol/L,所以NO2的转化率为(2×0.0125mol/L)÷0.1mol/L×100%=25%.
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

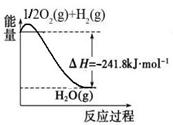
 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5. CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。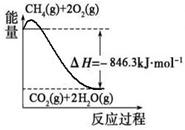
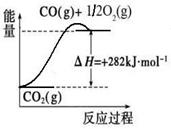
 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0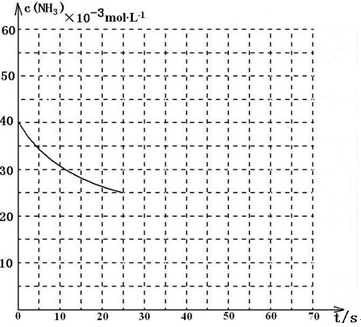
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
 CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1

 CO2(g) ΔH1<0①
CO2(g) ΔH1<0①