题目内容
18.反应N2+3H2?2NH3△H=-92.4kJ/mol 在密闭容器中进行并达到平衡,如果最初c (N2 )=4mol/L,c (H2)=8mol/L,反应达到平衡时有10%的N2转化,求:(1)达到平衡时,N2、H2和NH3的浓度各是多少?
(2)平衡时NH3占总体积百分数是多少?
分析 (1)反应达到平衡时有10%的N2转化,故氮气的浓度变化量为4mol/L×10%=0.4mol/L,根据三段式计算平衡时N2、H2和NH3的浓度;
(2)根据(1)的计算,结合平衡时NH3占总体积百分数氨气平衡浓度除以混合气体总浓度计算.
解答 解:(1)反应达到平衡时有10%的N2转化,故氮气的浓度变化量为4mol/L×10%=0.4mol/L,则:
N2+3H2?2NH3
开始(mol/L):4 8 0
变化(mol/L):0.4 1.2 0.8
平衡(mol/L):3.6 6.8 0.8
故平衡时N2、H2和NH3的浓度分别为3.6mol/L、6.8mol/L、0.8mol/L,
答:平衡时N2、H2和NH3的浓度分别为3.6mol/L、6.8mol/L、0.8mol/L;
(2)平衡时NH3占总体积百分数为:$\frac{0.8mol/L}{3.6mol/L+6.8mol/L+0.8mol/L}$×100%=7.1%,
答:平衡时NH3占总体积百分数为7.1%.
点评 本题考查化学平衡的有关计算,难度不大,注意三段式解题法的利用,掌握解题方法和概念实质是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.工业合成氨反应N2(g)+3H2(g)?2NH3(g).设在容积为2L的密闭容器中充入1.0mol氮气和1.6mol氢气,反应在一定条件下达到平衡时,NH3的物质的量为0.8mol.下列叙述正确的是( )
| A. | N2的转化率是60% | B. | 该反应的平衡常数 是12.5 | ||
| C. | 平衡时总物质的量是2.6mol | D. | 平衡时气体的密度是15.6g/L |
13.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| B. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| C. | 反应达到平衡时,X的转化率为50% | |
| D. | 改变温度可以改变此反应的平衡常数 |
3.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
8.下列各组物质按酸、碱、盐分类顺序排列的是( )
| A. | 硫酸、纯碱、食盐 | B. | HNO3、Ba(OH)2、CaO | ||
| C. | 碳酸,烧碱,葡萄糖 | D. | HCl,Ca(OH)2,NH4HSO4 |
 的系统命名2-甲基-3-乙基己烷
的系统命名2-甲基-3-乙基己烷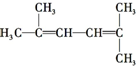
 的键线式:
的键线式:
 中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子. 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答: