题目内容
13.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| B. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| C. | 反应达到平衡时,X的转化率为50% | |
| D. | 改变温度可以改变此反应的平衡常数 |
分析 A、根据影响平衡常数的因素判断,平衡常数随温度变化;
B、根据反应物浓度减小,生成物浓度增加,浓度的变化量之比等于计量数之比,确定化学方程式,根据平衡常数的定义计算平衡常数;
C、根据转化率=$\frac{变化浓度}{起始浓度}$×100%计算;
D、根据影响平衡常数的因素判断.
解答 解:A、平衡常数随温度变化,增大压强,平衡正向进行,平衡常数不变,故A错误;
B、根据表中数据可知,在反应中X减小0.05mol/L,Y减小0.15mol/L,所以X、Y是反应物,Z增加了0.1mol/L,所以Z是生成物,X、Y、Z的浓度的变化量之比为1:3:2,所以化学方程式为X+3Y?2Z,平衡常数为$\frac{0.{1}^{2}}{0.05×0.0{5}^{3}}$=1600,故B正确;
C、根据转化率=$\frac{变化浓度}{起始浓度}$×100%可计算得X的转化率为$\frac{0.1-0.05}{0.1}$×100%=50%,故C正确;
D、对于某个反应来讲,平衡常数只与温度有关,温度改变,平衡常数也改变,故D正确;
故选A.
点评 本题主要考查转化率的计算、影响平衡常数的因素、化学方程式的确定及平衡常数的计算等知识点,难度不大.注重对基础知识的考查.

练习册系列答案
相关题目
4.下列各对物质中,互为同系物的是( )
| A. | CH3-CH=CH2与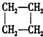 | B. |  与 与 | ||
| C. | 甲苯和二甲苯 | D. | CH2═CH-CH═CH2和CH-CH2-CH2-C≡CH |
8.将4molA气体和2molB气体在2L的容器中混合,一定条件下发生如下反应:2A(g)+B(g)=2C(g)若经2s(秒)后测得C的浓度为0.6mol•L-1,下列说法正确的是( )
| A. | 2s时物质A的转化率为70% | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 用物质A表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| D. | 2s时物质B的浓度为0.6mol•L-1 |
5. 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H<0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
①表中3min~4min之间反应处于平衡状态; C1数值大于0.08mol/L(填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是D(单选),表中5min~6min之间数值发生变化,可能的原因是C(单选).
A.使用催化剂 B.降低温度 C.增加水蒸气 D.增加氢气浓度.
 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H<0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 |
①表中3min~4min之间反应处于平衡状态; C1数值大于0.08mol/L(填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是D(单选),表中5min~6min之间数值发生变化,可能的原因是C(单选).
A.使用催化剂 B.降低温度 C.增加水蒸气 D.增加氢气浓度.
2.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下2.24L氯气与水充分反应转移电子数为0.1NA | |
| B. | 标况下,2.24LNO2分子总数小于0.1NA | |
| C. | 标准状况下2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
3.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 淀粉溶液、豆浆、雾均可发生丁达尔现象 | |
| B. | 生铁中含有碳,抗腐蚀能力比纯铁强 | |
| C. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒等作用 | |
| D. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |


 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析: