题目内容
下列有关说法正确的是( )
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,pH均为5的盐酸、氯化铵溶液中,水的电离程度相同 |
| C、8NH3(g)+6NO(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、对于乙酸乙酯的水解反应(△H>0),加入少量氢氧化钠溶液并加热,该反应的反应速率和平衡常数均增大 |
考点:化学反应速率的影响因素,焓变和熵变,水的电离
专题:
分析:A.铜发生吸氧腐蚀形成铜绿;
B.氯化铵为强酸弱碱盐,水解促进水的电离;
C.如反应能自发进行,应满足△H-T?△S<0;
D.乙酸乙酯的水解反应为吸热反应,加热或加入碱都能促进平衡正向移动.
B.氯化铵为强酸弱碱盐,水解促进水的电离;
C.如反应能自发进行,应满足△H-T?△S<0;
D.乙酸乙酯的水解反应为吸热反应,加热或加入碱都能促进平衡正向移动.
解答:
解:A.铜于酸不反应,在空气中发生吸氧腐蚀形成铜绿,故A错误;
B.氯化铵为强酸弱碱盐,水解促进水的电离,而盐酸抑制水的电离,故B错误;
C.反应的△H<0,且△S>0,则△H-T?△S<0,能自发进行,故C正确;
D.乙酸乙酯的水解反应为吸热反应,加热或加入碱都能促进平衡正向移动,且升高温度,平衡常数增大,故D正确.
故选CD.
B.氯化铵为强酸弱碱盐,水解促进水的电离,而盐酸抑制水的电离,故B错误;
C.反应的△H<0,且△S>0,则△H-T?△S<0,能自发进行,故C正确;
D.乙酸乙酯的水解反应为吸热反应,加热或加入碱都能促进平衡正向移动,且升高温度,平衡常数增大,故D正确.
故选CD.
点评:本题综合考查化学反应速率以及平衡移动问题,为高考常见题型,侧重于基本理论知识的综合理解和运用的考查,主要相关知识的积累,难度不大.

练习册系列答案
相关题目
化合物甲、乙、丙有如下反应转化关系:丙的结构简式不可能是( )


| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
等物质的量的乙醇、乙二醇、甘油,分别与足量金属钠作用,生成等物质的量的H2,则乙醇、乙二醇、甘油物质的量之比为( )
| A、6:3:2 |
| B、1:2:3 |
| C、3:2:1 |
| D、4:3:2 |
 一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )
一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )| A、d是ClO3- |
| B、b→a+c反应的活化能为60kJ?mol-1 |
| C、a,b,c,d中c最稳定 |
| D、b→a+c反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ?mol-1 |
在10mL0.1mol/L 的醋酸中逐滴加入0.1mol/L 的氢氧化钠溶液,当滴至混合液恰好呈中性时,消耗氢氧化钠溶液的体积( )
| A、等于10mL |
| B、小于10mL |
| C、大于10mL |
| D、无法判断 |
 有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示,
有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示,
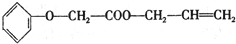 )的制备方法,据此回答问题:
)的制备方法,据此回答问题:
 (R-、R′-代表烃基)
(R-、R′-代表烃基) 的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为