题目内容
16.完成下列化学方程式(1)用氯化铵固体和氢氧化钙固体制备氨气
(2)碳和热的浓硝酸反应
(3)碳酸氢铵受热分解
(4)氨的催化氧化
(5)二氧化氮和水反应.
分析 (1)实验室利用氢氧化钙与氯化铵共热制取氨气;
(2)碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水;
(3)碳酸氢铵受热分解生成氨气、二氧化碳和水;
(4)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水;
(5)二氧化氮与水反应生成一氧化氮和硝酸.
解答 解:(1)铵盐和碱反应能生成氨气,实验室利用氢氧化钙与氯化铵共热制取氨气,该化学反应为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)碳单质和浓硝酸加热反应,碳被氧化成+4价的碳,自身被还原成+4价的氮,生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)碳酸氢铵不稳定,受热分解生成氨气、二氧化碳和水,反应的化学方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,
故答案为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O;
(4)氨气具有还原性,氧气具有氧化性,氨气中氮元素为-3价,被氧气氧化为+2价的氮元素,所以氨气和氧气反应生成一氧化氮和水,反应方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)二氧化氮与水反应,N元素的化合价由+4价变为+5价HNO3和+2价NO,反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO.
点评 本题考查了化学方程式的书写,题目难度不大,掌握物质性质以及化学方程式的书写原则是解答关键.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案| A. | 简单阳离子的氧化性:Z>X | |
| B. | 气态氢化物的稳定性:M>Y | |
| C. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| D. | 在X2M与Z2M的溶液中,水的电离程度,前者大于后者 |
| A. | 观察外观是否规则 | B. | 测定是否有固定的熔点 | ||
| C. | 进行X射线衍射实验 | D. | 验证是否有各向异性 |
| A. | 非金属性A>B>D | |
| B. | B和C形成的化合物中可能有共价键 | |
| C. | 原子序数D>C>A>B | |
| D. | 四种元素中,最高价氧化物对应的水化物酸性最强的是B |
 、
、 、
、 ;C6H5OCH3.
;C6H5OCH3. ;
;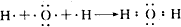 ;
;
 .
.