题目内容
10.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )| A. | 生成42.0 L N2(标准状况) | |
| B. | 转移电子的物质的量为1.25 mol | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,据此分析解答.
解答 解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,
A.生成2molN2,在标准状况下的体积为44.8L,故A错误;
B.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故B正确;
C.由反应可知,被还原的硝酸钾的物质的量为2mol×$\frac{2}{16}$=0.25mol,故C错误;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为$\frac{1.25×30}{10}$mol=3.75mol,故D正确;
故选BD.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查分析计算能力,明确氧化产物和还原产物关系是解本题关键,注意叠氮化钠中N元素化合价,为易错点.

| A. | Na+ 1s22s22p63s2 | B. | F 1s22s22p5 | ||
| C. | O2- 1s22s22p6 | D. | Ar 1s22s22p63s23p6 |
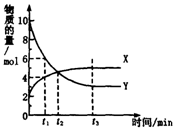 一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | 根据t2时的数据,可求出该温度下的平衡常数 | |
| D. | t3时,逆反应速率大于正反应速率 |
| A. | 在受热条件下,HD能还原氧化铜 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种非金属单质 | |
| D. | 是一种化合物 |
| A. | 离子晶体在熔化状态下能导电 | |
| B. | 在晶体中只要有阴离子就一定有阳离子 | |
| C. | 原子晶体中一定有非极性共价键 | |
| D. | 分子晶体中不一定含有共价键 |

下列说法中正确的是( )
| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |
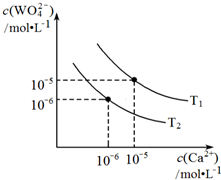 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:Ⅰ.WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq) K1
已知:反应Ⅰ的平衡常数K1理论值如下表
| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
(1)判断反应Ⅰ的△S>0、△H>0(填“>”、“=”或“<”),在较高(填“较高”或“较低”)温度下有利于该反应自发进行.
(2)氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,溶解度均随温度升高而减小.它们在水中存在如下沉淀溶解平衡:
Ⅱ.CaWO4(s)?Ca2+(aq)+WO42ˉ(aq) K2
Ⅲ.Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq) K3
①根据反应Ⅰ~Ⅲ,可推导出K1、K2与K3之间的关系,则K1=K1=$\frac{{K}_{3}}{{K}_{2}}$(用K2、K3表示).
②根据反应Ⅱ,图为不同温度下CaWO4的沉淀溶解平衡曲线.则T1<T2(填“>”“=”或“<”).T1时,向0.5mol•Lˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,此时溶液中c(Ca2+)=5×10ˉ10mol•Lˉ1.(假设反应前后体积不变)
(3)制取钨酸钙时,适时向反应混合液中添加适量的某种酸性物质,有利于提高WO42ˉ的转化率.反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3.
①在反应混合液中不直接通入CO2,其理由是碱性条件下CO2与Ca2+生成难溶物CaCO3,降低WO42ˉ的转化率;
②用平衡移动原理解释添加酸性物质的理由加入酸性物质与OHˉ反应,使溶液中OHˉ浓度减小,平衡向生成CaWO4的方向移动.
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
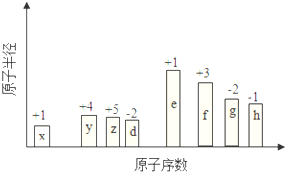 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.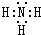 .位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.
.位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.