题目内容
10.一定质量的Zn片与足量盐酸反应,欲使反应速率增大,产生的H2质量不变,可采取下列哪些措施( )| A. | 增加Zn片质量 | B. | 增加盐酸的体积 | ||
| C. | 滴加几滴CuSO4溶液 | D. | 升高温度 |
分析 提高该反应的速率,可升高温度,增大浓度以及增大锌的表面积,产生的H2质量不变,则与酸反应生成氢气的锌的量不变,以此解答该题.
解答 解:A.增加Zn片质量,生成氢气的量增多,故A错误;
B.增加盐酸的体积,如浓度不变,则反应速率不变,故B错误;
C.滴加几滴CuSO4溶液,锌置换出铜,消耗锌,生成氢气的量减少,故C错误;
D.升高温度,反应速率增大,生成氢气的总量不变,故D正确.
故选D.
点评 本题考查反应速率的影响因素,为高考高频考点,注意把握影响反应速率的因素,难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
1.关于胶体的说法正确的是( )
| A. | 胶体是纯净物 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | Al(OH)3胶体具有很强的吸附能力,能凝聚水中的悬浮物,也能吸附色素,可做净水剂 | |
| D. | 胶体粒子可以透过半透膜 |
18.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
5.下列离子能在NaOH溶液中大量存在的是( )
| A. | Fe3+ | B. | H+ | C. | Ba2+ | D. | Cu2+ |
15.氨是化学实验室及化工生产中的重要物质,应用广泛.
(1)已知25℃时:N2(g)+O2(g)?2NO(g)△H=+183kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1164.4kJ/mol
则 N2(g)+3H2(g)?2NH3(g)△H=-92.2KJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为K=$\frac{c(N{H}_{3})^{2}}{c({N}_{2})c({H}_{2})^{3}}$.
②按投料Ⅱ进行反应,起始时反应进行的方向为正向(填“正向”或“逆向”).
③若升高温度,则合成氨反应的化学平衡常数变小(填“变大”、“变小”或“不变”).
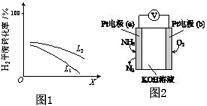
④L(L1、L2)、X可分别代表压强或温度.如图1表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系.
ⅰX代表的物理量是温度.
ⅱ判断L1、L2的大小关系,L1<L2.(填“>”“<”或“=”)
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图2:
①电极b上发生的是还原反应(填“氧化”或“还原”)
②写出电极a的电极反应式:2NH3-6e-+6OH-=N2+6H2O.
(1)已知25℃时:N2(g)+O2(g)?2NO(g)△H=+183kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1164.4kJ/mol
则 N2(g)+3H2(g)?2NH3(g)△H=-92.2KJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
②按投料Ⅱ进行反应,起始时反应进行的方向为正向(填“正向”或“逆向”).
③若升高温度,则合成氨反应的化学平衡常数变小(填“变大”、“变小”或“不变”).
④L(L1、L2)、X可分别代表压强或温度.如图1表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系.
ⅰX代表的物理量是温度.
ⅱ判断L1、L2的大小关系,L1<L2.(填“>”“<”或“=”)
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图2:
①电极b上发生的是还原反应(填“氧化”或“还原”)
②写出电极a的电极反应式:2NH3-6e-+6OH-=N2+6H2O.

2.下列说法正确的是( )
| A. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| B. | 自发过程将一定导致体系的熵值增大 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有过程的方向的判断 | |
| D. | 增大反应物的浓度可增大单位体积活化分子百分数,从而使有效碰撞次数增多 |
19.全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2下列说法正确的是( )
| A. | 该反应中Cu2S只是还原剂 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中SO2既是氧化产物又是还原产物 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
 .
.