题目内容
1.有A、B两种元素,已知元素A的核电荷数为a,且A3+与Bn-的核外电子排布完全相同,则元素B的核电荷数为( )| A. | a-n-3 | B. | a+n+3 | C. | a+n-3 | D. | a-n+3 |
分析 根据题意,A元素原子的核电荷数为a,A3+与Bn-的电子层排布相同,两种离子的核外电子总数一定相等,据此由原子和离子之间的转化进行分析解答即可.
解答 解:A元素原子的核电荷数为a,原子中核电荷数=核内质子数=核外电子数,则其核外电子数为a;A原子失去3个电子形成A3+,则A3+的核外电子数为a-3,
B原子得到n个电子形成Bn-,设B的核电荷数为x,由于A3+与Bn-的电子层排布相同,则:a-3=x+n,解得:x=a-n-3,
所以元素B的核电荷数为a-n-3,
故选A.
点评 本题考查原子核外电子排布,题目难度不大,掌握原子和离子之间的相互转化、原子中核电荷数=核内质子数=核外电子数是正确解答本题的关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.具有下列电子排布式的原子中,半径最大的是( )
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22sp5 | D. | 1s22s22p63s23p4 |
12.四种短周期元素A、B、C、D的原子序数依次增大,其中A与C,B与D同主族.常温下A的单质是密度最小的气体;B的最高正价与最低负价的代数和为0.下列判断正确的是( )
| A. | A、C两种元素组成的化合物CA为共价化合物 | |
| B. | B元素可形成多种同素异形体 | |
| C. | C元素存在多种核素 | |
| D. | D的氧化物是两性氧化物 |
9.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 溴苯和水 | B. | 乙酸和水 | C. | 酒精和水 | D. | 硝基苯和苯 |
16.核素90Th的相对原子质量约为232,则其核内的中子数与核外电子数之差是( )
| A. | 52 | B. | 90 | C. | 142 | D. | 232 |
6.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、OH-、NO3-、HSO3- |
13.选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO2,下列说法正确的是( )
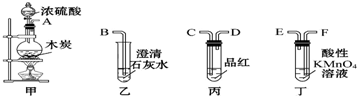

| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |
10.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. | 石墨与金刚石 | D. |  与 与  |
11.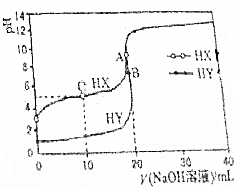 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )| A. | 根据滴定曲线,可得Ka(CH3COOH)≈10-5 | |
| B. | pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL | |
| C. | C点溶液:c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+) |