题目内容
2.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应且生成两种有机物的X的同分异构体有(不考虑立体异物)( )| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
分析 有机物X的蒸气相对氢气的密度为51,则X的相对分子质量为51×2=102,X中氧元素的质量分数为31.7%,则分子中N(O)=$\frac{102×31.7%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,能在碱性溶液中发生反应且生成两种有机物,则有机物X属于酯,从而判断同分异构体.
解答 解:有机物X的蒸气相对氢气的密度为51,则X的相对分子质量为51×2=102,X中氧元素的质量分数为31.7%,则分子中N(O)=$\frac{102×31.7%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,分子式为C5H10O2的有机物能在碱性溶液中发生反应且生成两种有机物,则有机物X属于酯,
若为甲酸和丁醇酯化,丁醇有4种,可形成4种酯;
若为乙酸和丙醇酯化,丙醇有2种,可形成2种酯;
若为丙酸和乙醇酯化,丙酸有1种,可形成1种酯;
若为丁酸和甲醇酯化,丁酸有2种,可形成2种酯;
所以共有9种酯;
故选B.
点评 本题考查有机物分子式的确定、同分异构体书写、官能团的性质等,计算确定有机物的分子式、确定酯的种类是解题的关键,注意掌握官能团的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.在①、②、③容积不等的恒容密闭容器中,均充入0.lmol CO和0.2mol H2,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是( )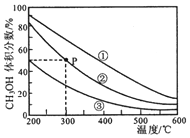

| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
10.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.请回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)?Fe(s)+CO2(g) K1△H1=a KJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g) K2△H2=b KJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g) K3△H3=c KJ•mol-1
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=$\frac{6a+b+2c}{3}$KJ•mol-1(用含a、b、c的代数式表示).
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图1所示.则a>b,(填“>”、“<”或“=”),理由是由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b.
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,如图2,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是b.

(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,将l mol CO和3mol H2加入2L的密闭容器中.实验测得n(CO)随时间的变化如表:
①下列能判断该反应达到平衡的标志是ad(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20min内v (H2)=0.04mol•L-1•min-1;在T℃时该反应的平衡常数K=1200.
③图3表示该反应中CO的转化率与温度、压强的关系.图中压强P1、P2、P3由高到低的顺序是P1>P2>P3.
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)?Fe(s)+CO2(g) K1△H1=a KJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g) K2△H2=b KJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g) K3△H3=c KJ•mol-1
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=$\frac{6a+b+2c}{3}$KJ•mol-1(用含a、b、c的代数式表示).
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图1所示.则a>b,(填“>”、“<”或“=”),理由是由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b.
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,如图2,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是b.

(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,将l mol CO和3mol H2加入2L的密闭容器中.实验测得n(CO)随时间的变化如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20min内v (H2)=0.04mol•L-1•min-1;在T℃时该反应的平衡常数K=1200.
③图3表示该反应中CO的转化率与温度、压强的关系.图中压强P1、P2、P3由高到低的顺序是P1>P2>P3.
14.镁锰干电池中反应的化学方程式为Mg+2MnO2+H2O═Mg (OH)2+Mn2O3.下列说法正确的是( )
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
11.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在标准状况下,78g苯的碳碳双键数目为3NA | |
| B. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| C. | 500mL2mol/LNH4NO3溶液中,含有氮原子数目为2NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子数效目一定为NA |
6.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).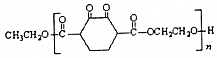 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: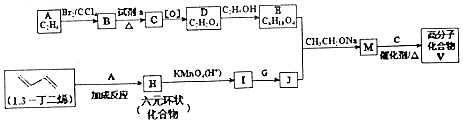
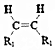 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH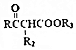 +R1OH
+R1OH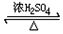 CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.