题目内容
1.图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,K是一种红棕色气体,D的俗名叫铁红,A是形成酸雨的主要气体.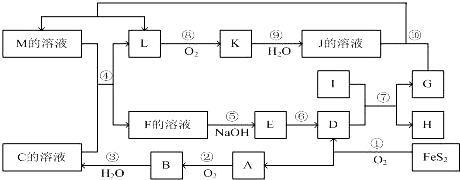
请填写下列空白:
(1)推导出下列物质的化学式:C:H2SO4 E:Fe(OH)3
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是③(填写序号).
(3)反应⑦的化学方程式是:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
反应⑩的离子方程式是:3Fe+2NO3-+8H++=3Fe2++2NO↑+4H2O.
反应④的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(4)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O.该反应的化学方程式是:Fe2O3.
分析 I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,判断为Al,K是一种红棕色气体,判断为NO2;D的俗名叫铁红为Fe2O3;,A是形成酸雨的主要气体为SO2,由反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④M+H2SO4 →F+NO↑知,M为Fe(NO3)2、F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2,据此进行解答.
解答 解:I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,判断为Al,K是一种红棕色气体,判断为NO2;D的俗名叫铁红为Fe2O3;,A是形成酸雨的主要气体为SO2,由反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2,
(1)依据题干条件和推断,A是酸雨主要成分为:SO2,A$\stackrel{O_{2}}{→}$B$\stackrel{H_{2}O}{→}$C,推知C为H2SO4;D为铁红Fe2O3,E为Fe(OH)3,
故答案为:H2SO4 ;Fe(OH)3;
(2)反应②为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;是化合反应、氧化还原反应;反应③为:SO3+H2O=H2SO4;化合反应、非氧化还原反应;反应⑥为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,;分解反应、非氧化还原反应;反应⑨为:3NO2+H2O=2HNO3+NO;氧化还原反应;在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是③,
故答案为:③
(3)反应⑦的化学方程式为铝热反应,化学方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
反应⑩的离子方程式是3Fe+2 NO3-+8H++=3Fe2++2NO↑+4H2O;
反应④是硝酸亚铁和硫酸反应,利用溶液中的稀硝酸把亚铁离子氧化,反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;3Fe+2 NO3-+8H++=3Fe2++2NO↑+4H2O;3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
( 4 )将化合物D(Fe2O3)与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O,该反应的化学方程式是:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
点评 本题考查较为综合,涉及化学反应类型、原电池的原理应用,氧化还原反应等知识,物质的量不同产物不同,利用反应的量判断生成产物,题目难度中等,注意把握电极反应式的书写方法.

 阅读快车系列答案
阅读快车系列答案| A. | 丙烷分子中三个碳原子共平面 | B. | 丁烷的一氯代物共有4种 | ||
| C. | 正丁烷的4个碳原子在一直线上 | D. | CnH2n+2的烃中含有3n+1个共价键 |
| A. | 漂白粉的有效成分是Ca(ClO)2,应密封保存 | |
| B. | 紫色石蕊试液中通入过量二氧化硫气体,溶液将先变红后褪色 | |
| C. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| D. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| A. | 氯水 | B. | 液氨 | C. | 氨水 | D. | 漂白粉 |
 用下列方法制备乙烯,并用右图装置检验乙烯,不需要除杂的是( )
用下列方法制备乙烯,并用右图装置检验乙烯,不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的水溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | 水玻璃是硅酸钠的俗称 | |
| C. | 单质硅是一种重要的半导体材料 | |
| D. | 二氧化硅能与氧化钙反应生成一种盐 |