题目内容
17.取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )| A. | 醋酸与锌反应放出氢气多 | |
| B. | 从反应开始到结束所需时间盐酸短 | |
| C. | 醋酸与锌反应速率大 | |
| D. | 盐酸和醋分别与锌反应的速度一样大 |
分析 pH=2的盐酸溶液中氢离子浓度为0.01mol/L,pH=1、体积为100mL盐酸溶液物质的量=0.01mol/L×0.1L=0.001mol,盐酸完全反应需要锌的质量$\frac{0.001mol}{2}$×65g/mol=0.0325g>0.03g,所以盐酸有剩余,醋酸是弱酸,其物质的量大于0.001mol,据此分析解答.
解答 解:醋酸为弱酸,等pH时,醋酸浓度较大,
A.醋酸浓度大,等体积时醋酸生成氢气多,两者酸过量,所以锌完全反应,放出氢气样多,故A错误;
B.醋酸的浓度大,则生成氢气的速率快,所以从反应开始到结束所需时间醋酸短,故B错误;
C.醋酸的浓度大,则生成氢气的速率快,故C正确;
D.醋酸浓度大,反应速率较大,故D错误;
故选C.
点评 本题考查弱电解质电离,为高频考点,侧重于学生的分析能力的考查,明确生成的氢气和酸的关系、反应速率和氢离子浓度关系即可解答,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7. 食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )
食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )
 食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )
食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )| A. | 油酸的分子式为C18H34O2 | |
| B. | 油酸可与氢氧化钠溶液发生中和反应 | |
| C. | 1 mol油酸可与2 mol H2发生加成反应 | |
| D. | 1 mol甘油可与3 mol油酸发生酯化反应 |
8.下列分子中各原子都满足了8电子稳定构型的是( )
| A. | H2O | B. | SF4 | C. | BF3 | D. | PCl3 |
5.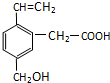 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )
①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能使溴水褪色;
⑥能发加成反应.
 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能使溴水褪色;
⑥能发加成反应.
| A. | ①④ | B. | 只有⑥ | C. | 只有⑤ | D. | 全部 |
2.选择下列某种答案的序号,填入表的空格.
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质名称 | 正丁烷与异丁烷 | 红磷与白磷 | 庚烷与戊烷 | 氯仿与三氯甲烷 | 氕与氘、氚 |
| 相互关系 | ③ | ② | ④ | ⑤ | ① |
9.由CuO、Fe2O3组成的混合物中,两种化合物的物质的量之和是0.2 mol,放入500mL 1.0mol•L-1的盐酸溶液中,混合物恰好完全溶解.则混合物中CuO的物质的量为( )
| A. | 0.05mol | B. | 0.125mol | C. | 0.175mol | D. | 0.025mol |
8.在容积不变的密闭容器中加入1mol N2和3mol H2反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,容器内压强增大,平衡向右移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
9.用标准的碱液滴定某酸时,下列操作错误的是( )
| A. | 滴定时眼睛应注视锥形瓶 | B. | 锥形瓶用待测液润洗2-3次 | ||
| C. | 滴定时不断地摇动锥形瓶 | D. | 滴定前排出管内液体中的气泡 |