题目内容
(1)OH-的摩尔质量为 ,3.01×1023个OH-的物质的量为 ,它与标准状况下 L的NH3的物质的量相等,与 gNa+含有的离子数目相同.
(2)在300mL 2mol/L H2SO4 溶液中,此溶液中含H+的物质的量是 ,从中取出10mL,其中含有 个 SO42-,将取出的10mL溶液稀释到100mL,其中SO42-的物质的量浓度是 .
(2)在300mL 2mol/L H2SO4 溶液中,此溶液中含H+的物质的量是
考点:物质的量的相关计算,物质的量浓度的相关计算
专题:
分析:(1)根据n=
计算OH-的物质的量,根据V=nVm计算氨气的体积,根据m=nM计算Na+的质量;
(2)根据n=cV计算硫酸的物质的量,求溶液中H+的物质的量是硫酸的2倍;
溶液是均匀的,取出的氢离子浓度与原溶液中相等,为硫酸浓度的2倍,根据n=cV计算SO42-的物质的量,再根据N=nNA计算SO42-数目,根据c=
,计算稀释后SO42-的物质的量浓度.
| N |
| NA |
(2)根据n=cV计算硫酸的物质的量,求溶液中H+的物质的量是硫酸的2倍;
溶液是均匀的,取出的氢离子浓度与原溶液中相等,为硫酸浓度的2倍,根据n=cV计算SO42-的物质的量,再根据N=nNA计算SO42-数目,根据c=
| n |
| V |
解答:
解:(1)OH-的摩尔质量为17g/mol,OH-的物质的量为
=0.5mol,与氢氧根等物质的量的氨气的体积0.5mol×22.4L/mol=11.2L,Na+的质量为0.5mol×23g/mol=11.5g,
故答案为:17g/mol;0.5mol;11.2;11.5;
(2)在 300mL2mol/L H2SO4 溶液中n(H2SO4)=0.3L×2mol/L=0.6mol,溶液中含 H+ 的物质的量:n(H+)=2n(H2SO4)=2×0.6mol=1.2,
c(SO42-)=c(H2SO4)=2mol/L,故n(SO42-)=0.01L×2mol/L=0.02mol,所以N(SO42-)=0.02mol×NAmol-1=0.02NA,将取出的溶液稀释到100mL,其中SO42-的物质的量浓度为
=0.2mol/L,
故答案为:1.2mol;0.02NA;0.2mol/L.
| 3.01×1023 |
| 6.02×1023mol-1 |
故答案为:17g/mol;0.5mol;11.2;11.5;
(2)在 300mL2mol/L H2SO4 溶液中n(H2SO4)=0.3L×2mol/L=0.6mol,溶液中含 H+ 的物质的量:n(H+)=2n(H2SO4)=2×0.6mol=1.2,
c(SO42-)=c(H2SO4)=2mol/L,故n(SO42-)=0.01L×2mol/L=0.02mol,所以N(SO42-)=0.02mol×NAmol-1=0.02NA,将取出的溶液稀释到100mL,其中SO42-的物质的量浓度为
| 0.02mol |
| 0.1L |
故答案为:1.2mol;0.02NA;0.2mol/L.
点评:本题考查物质的量和物质的量浓度及物质的量的有关计算,难度不大,注意掌握以物质的量为中心的有关计算,有利于基础知识的巩固.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 氢能是重要的新能源,储氢技术的开发对于氢能源的推广应用是一个非常关键的技术,是当前关注的热点之一,其中有一种可借助有机物储氢,如图所示,一定条件下,该装置有机物的电化学储氢(忽略其他有机物),下列说法不正确的是( )
氢能是重要的新能源,储氢技术的开发对于氢能源的推广应用是一个非常关键的技术,是当前关注的热点之一,其中有一种可借助有机物储氢,如图所示,一定条件下,该装置有机物的电化学储氢(忽略其他有机物),下列说法不正确的是( )| A、在外电路,电流方向是从D→A |
| B、生成目标产物的电极反应式为:C6H6+6H++6e-=C6H12 |
| C、通过电化学储氢后,收集到的混合气仍为10mol |
| D、该储氢装置的电流效率η=64.3%(η=生成目标产物消耗的电子数/转移的电子总数×100%) |
下列离子方程式中正确的是( )
| A、CO32-+H+═CO2↑+H2O |
| B、Cu+Zn2+═Cu2++Zn |
| C、Zn(OH)2+2H+═Zn2++2H2O |
| D、Cl-+AgNO3═AgCl↓+NO3 |
下列关于叙述正确的是( )
| A、室温下,浓度均为0.05mol/L的NaOH溶液和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12 |
| B、室温下,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,2c(SO42-)>c(NH4+) |
| C、室温下,0.1mol/L的盐酸和0.1mol/L的氢氧化钡等体积混合,混合后溶液pH=7 |
| D、室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后的溶液pH>7 |
下列装置所示的实验中,能达到实验目的是( )
A、 实验制氨气 |
B、 除去Cl2中的HCl |
C、 Na2CO3及NaHCO3热稳定性比较 |
D、 铁制品表面镀锌 |
甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )

| A、乙的单质在空气中燃烧生成的化合物只含离子键 |
| B、丙、己位于金属与非金属过渡线附近 |
| C、丁与已核外电子数相差12 |
| D、戊和己是过渡元素 |
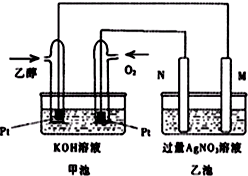 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: (R,R′可以是相同的烃基,也可能是不同的烃基)
(R,R′可以是相同的烃基,也可能是不同的烃基) 的过程如下(反应条件和部分产物没有列出):
的过程如下(反应条件和部分产物没有列出):