题目内容
6.下列关于蛋白质的叙述中不正确的是( )| A. | 向蛋白质溶液中加饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 | |
| B. | 蛋白质溶液中蛋白质分子能通过滤纸,但不能通过半透膜 | |
| C. | 浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质和浓硝酸发生颜色反应 | |
| D. | 重金属盐能使蛋白质变性,吞服钡餐不会引起中毒 |
分析 A、盐析是可逆的,加水可溶解;
B、蛋白质溶液是胶体,胶体能通过滤纸,但不能通过半透膜;
C、皮肤组成重要成分是蛋白质,含有苯环的蛋白质遇浓硝酸发生颜色反应;
D、重金属盐能使蛋白质变性,钡餐的成分是硫酸钡,硫酸钡不溶于酸,无法生成钡离子;
解答 解:A、蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水会溶解,盐析是可逆的,故A错误;
B、蛋白质溶液中蛋白质分子能通过滤纸,不能通过半透膜,故B正确;
C、皮肤组成重要成分是蛋白质,浓硝酸沾到皮肤上能使皮肤变黄,这是由于浓硝酸和含有苯环的蛋白质遇发生了颜色反应,故C正确.
D、重金属盐能使蛋白质变性,钡餐的成分是硫酸钡,硫酸钡不溶于酸,无法生成钡离子,不会引起中毒,故D正确;
故选A.
点评 本题主要考查了蛋白质的性质,应注意蛋白质的盐析是可逆的,而变性是不可逆的,难度不大.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
3.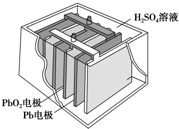 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |
1.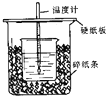 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所测得的中和热的数值会偏小(填“偏大”“偏小”“无影响”).
(2)某探究实验小组的同学,在进行高锰酸钾酸性溶液与草酸溶液的反应时,发现刚开始的一段时间,反应速率较慢,溶液褪色不明显,但不久后褪色速度明显加快,最后紫红色完全消失.已知草酸与高锰酸钾酸性溶液的反应为:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O
该小组探究后一阶段褪色速度明显加快的原因:
①设计对比实验:室温下,在三支试管中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,再对应加入固体粉末,记录褪色时间.实验数据如下:
设计该实验的目的及实验得出的结论分别是:探究后一阶段褪色速度明显加快的原因;Mn2+作催化剂,加快反应速率;.
②理论分析:依据该反应的原理,推测反应可能是放热反应,温度影响了反应的速率.请你设计一个简单的实验来验证该推测.你的实验操作是:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间.
(3)某研究发现O3氧化海水中的I-是大气中碘的主要来源.通过将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,为测定生成I2的量,用酸式滴定管取20.00mL反应后的溶液与锥形瓶中,用cmol•L-1的Na2S2O3标准液滴定,消耗V mL Na2S2O3溶液.
已知:Ⅰ.H2S2O3是一种弱酸;Ⅱ.2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶、酸式滴定管外,还需要的玻璃仪器是碱式滴定管;
②该滴定实验中可选用淀粉作指示剂(填物质名称);
③实验测得溶液中碘的含量为6.35cVg•L-1(用含c和V的关系式表示).
 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:①从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所测得的中和热的数值会偏小(填“偏大”“偏小”“无影响”).
(2)某探究实验小组的同学,在进行高锰酸钾酸性溶液与草酸溶液的反应时,发现刚开始的一段时间,反应速率较慢,溶液褪色不明显,但不久后褪色速度明显加快,最后紫红色完全消失.已知草酸与高锰酸钾酸性溶液的反应为:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O
该小组探究后一阶段褪色速度明显加快的原因:
①设计对比实验:室温下,在三支试管中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,再对应加入固体粉末,记录褪色时间.实验数据如下:
| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
②理论分析:依据该反应的原理,推测反应可能是放热反应,温度影响了反应的速率.请你设计一个简单的实验来验证该推测.你的实验操作是:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间.
(3)某研究发现O3氧化海水中的I-是大气中碘的主要来源.通过将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,为测定生成I2的量,用酸式滴定管取20.00mL反应后的溶液与锥形瓶中,用cmol•L-1的Na2S2O3标准液滴定,消耗V mL Na2S2O3溶液.
已知:Ⅰ.H2S2O3是一种弱酸;Ⅱ.2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶、酸式滴定管外,还需要的玻璃仪器是碱式滴定管;
②该滴定实验中可选用淀粉作指示剂(填物质名称);
③实验测得溶液中碘的含量为6.35cVg•L-1(用含c和V的关系式表示).
18.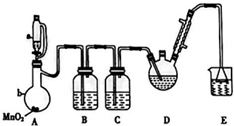 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
已知:实验室制备三氯乙醛的反应为C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应为C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH+HCl.
回答下列问题:
(1)恒压漏斗a中盛放的试剂是浓盐酸,仪器b的名称是蒸馏烧瓶.
(2)装置B的作用是除去氯气中的氯化氢;若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右;装置E的作用是吸收氯气的尾气,防止环境污染.
(3)反应结束后,有同学提出先将装置D中的混合物冷却到室温,再用分液的方法分高出C2H5Cl,此方案不可行(填“可行”或“不可行”),理由是CCl3COOH溶于乙醇与CCl3CHO.
(4)测定产品纯度的方法如下,称取产品0.36g,配成待测溶液,加入20.00mL0.1000mol•L-1标准碘溶液,再加入适量Na2CO3溶液,反应完全后,加入盐酸调节溶液的pH,立即用0.02000 mol•L-1的Na2S2O3溶液滴定至终点,进行平行实验后,测得消耗Na2S2O3溶液20.00mL,滴定的反应原理为CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2→H++2I-+CO2↑;I2+2S2O32-═2I-+S2Cl-.则产品的纯度为73.75%%.
(5)设计实验证明三氯乙酸是弱酸是:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:| 物质 | C2H5OH | CCl3CHO | CCl3COOH | C6H5Cl |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)恒压漏斗a中盛放的试剂是浓盐酸,仪器b的名称是蒸馏烧瓶.
(2)装置B的作用是除去氯气中的氯化氢;若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右;装置E的作用是吸收氯气的尾气,防止环境污染.
(3)反应结束后,有同学提出先将装置D中的混合物冷却到室温,再用分液的方法分高出C2H5Cl,此方案不可行(填“可行”或“不可行”),理由是CCl3COOH溶于乙醇与CCl3CHO.
(4)测定产品纯度的方法如下,称取产品0.36g,配成待测溶液,加入20.00mL0.1000mol•L-1标准碘溶液,再加入适量Na2CO3溶液,反应完全后,加入盐酸调节溶液的pH,立即用0.02000 mol•L-1的Na2S2O3溶液滴定至终点,进行平行实验后,测得消耗Na2S2O3溶液20.00mL,滴定的反应原理为CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2→H++2I-+CO2↑;I2+2S2O32-═2I-+S2Cl-.则产品的纯度为73.75%%.
(5)设计实验证明三氯乙酸是弱酸是:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
15.NA表示阿伏加德罗的值,下列有关说法正确的是( )
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
16.下列关于有机物的说法正确的是( )
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物,都能发生水解反应 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
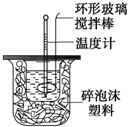 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: